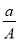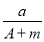题目内容
金刚石、SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子。碳元素在周期表中的位置是____________,Q是____________,R的电子式为________。
(2)一定条件下,Na还原CCl4可制备金刚石。反应结束冷却至室温后,回收其中的CCl4的实验操作名称为________,除去粗产品中少量钠的试剂为________。
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2。现将20.0 g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1 mol氢气,过滤得SiC固体11.4 g,滤液稀释到1 L。生成氢气的离子方程式为__________________________________,硅酸盐的物质的量浓度为_________。
(4)下列叙述正确的有________(填序号)。
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1:2
(1)第二周期第ⅣA族 氧(或O)
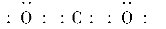
(2)过滤 水(或乙醇)
(3)Si+2OH-+H2O=SiO32-+2H2↑ 0.17 mol·L-1
(4)③④
【解析】(1)由题意可知Q为O(氧),形成的化合物R为CO2,其电子式为: 。(2)因为CCl4为液体,C和Na都为固体,所以用过滤法分离;除去C(金刚石)中的Na可以用水或乙醇。(3)混合物中的Si可以与NaOH溶液反应生成氢气,离子方程式为Si+2OH-+H2O=SiO32-+2H2↑。由于杂质SiO2也能生成Na2SiO3,所以可先求混合物中SiO2的质量,再求硅酸盐的物质的量浓度。
。(2)因为CCl4为液体,C和Na都为固体,所以用过滤法分离;除去C(金刚石)中的Na可以用水或乙醇。(3)混合物中的Si可以与NaOH溶液反应生成氢气,离子方程式为Si+2OH-+H2O=SiO32-+2H2↑。由于杂质SiO2也能生成Na2SiO3,所以可先求混合物中SiO2的质量,再求硅酸盐的物质的量浓度。
Si ~ 2H2
28 g 2 mol
1.4 g 0.1 mol
m(SiO2)=20.0 g-11.4 g-1.4 g=7.2 g
n(SiO2)=0.12 mol
所以n(Na2SiO3)=n(Si)+n(SiO2)= +0.12 mol=0.17 mol
+0.12 mol=0.17 mol
c(Na2SiO3)=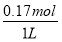 =0.17 mol·L-1。
=0.17 mol·L-1。
(4)①中Cl2与H2O的反应不是置换反应;②中水晶熔化克服的是共价键,干冰熔化克服的是分子间作用力,两者不同;③④说法正确。

 阅读快车系列答案
阅读快车系列答案下表是元素周期表的一部分,有关说法正确的是( )
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 |
|
|
| c |
| d |
|
3 | a | b |
|
|
| e | f |
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强