题目内容
(1)浓度均为0.01 mol·L-1的8种溶液:①HNO3 ②H2SO4 ③CH3COOH ④Ba(OH)2 ⑤NaOH
⑥CH3COONa ⑦KCl ⑧NH4Cl,这些溶液pH由小到大的顺序是(填写编号) 。
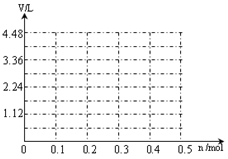
(2)pH=2的某酸HnA(An+为酸根)与pH=12的某碱B(OH)m混合,恰好反应生成正盐,混合液pH=8。
①反应生成的正盐的化学式为 。
②该盐中 离子一定能水解,其第一步水解的离子方程式为 。
⑥CH3COONa ⑦KCl ⑧NH4Cl,这些溶液pH由小到大的顺序是(填写编号) 。
(2)pH=2的某酸HnA(An+为酸根)与pH=12的某碱B(OH)m混合,恰好反应生成正盐,混合液pH=8。
①反应生成的正盐的化学式为 。
②该盐中 离子一定能水解,其第一步水解的离子方程式为 。
(1)②①③⑧⑦⑥⑤④
(2)①BnAm ②An- An-+H2O HA(n-1)-+OH-
HA(n-1)-+OH-
(2)①BnAm ②An- An-+H2O
 HA(n-1)-+OH-
HA(n-1)-+OH-(1)首先分组:溶液呈酸性的有①②③⑧;溶液呈中性的有⑦;溶液呈碱性的有④⑤⑥。
(2)恰好完全反应所得正盐的溶液呈碱性,说明生成了强碱弱酸盐。
(2)恰好完全反应所得正盐的溶液呈碱性,说明生成了强碱弱酸盐。

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
 ’
’ Al2O3
Al2O3 Al(NO3)3
Al(NO3)3 Al2O3
Al2O3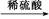 CuSO4溶液
CuSO4溶液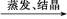 CuSO4·5H2O
CuSO4·5H2O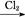 FeCl3
FeCl3 Fe(OH)3
Fe(OH)3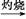 Fe2O3
Fe2O3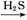 FeS
FeS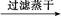 FeS
FeS HCOO-+H3O+
HCOO-+H3O+ HC+H+
HC+H+ HC+OH-
HC+OH-