题目内容
mg铁粉与Fe2O3组成的混合物投入到足量的稀H2SO4中,混合物完全溶解后在标准状况下收集到V LH2,所得溶液遇KSCN溶液不显红色,则混合物中Fe2O3物质的量为( )
| A.2.5V mol | B.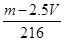 mol mol | C.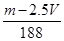 mol mol | D.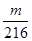 mol mol |
B
试题分析:所得溶液遇KSCN溶液不显红色,说明溶液中不存在铁离子,所以反应的方程式应该是Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe2(SO4)3+Fe=3FeSO4、Fe+H2SO4=FeSO4+H2↑。如果时氧化铁的物质的量是x,则160x+56x+V/22.4×56=m,解得x=
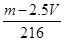 mol,答案选B。
mol,答案选B。点评:在计算时特别要注意铁离子的氧化性强于氢离子的,因此首先氧化单质铁的是铁离子,题号才是氢离子,据此可以进行有关计算。

练习册系列答案
相关题目