题目内容
【题目】氯化亚铜是有机合成工业中应用较广的催化剂。
(1)CuCl用作制备碳酸二甲酯的催化剂:4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,请填写化学方程式将催化原理补充完整:i.4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O;ii.________________________。
2(CH3O)2CO+2H2O,请填写化学方程式将催化原理补充完整:i.4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O;ii.________________________。
(2)一种用废铜制备氯化亚铜的过程如下:
Cu(s)+Cl2(g)=CuCl2(s) △H=-a kJ·mol-1
CuCl2(s) +Cu(s) +4HCl(aq)=2H2[CuCl3] (aq) △H=+b kJ·mol-1
CuCl(s) + 2HCl(aq)H2[CuCl3] (aq) △H=-c kJ·mol-1
①反应 2Cu(s)+Cl2(g)=2CuCl(s) △H=_______________ kJ·mol-1(用含 a、b、c 的式子表示)
②向CuCl2 溶液中加入过量铜粉,发生反应生成CuC1。但在实验过程中要加入浓盐酸反应才能持续进行,反应结束后将溶液倒入蒸馏水中稀释获得CuCl。加入浓盐酸的目的是___________________。
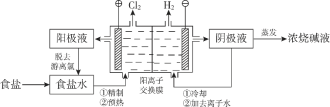
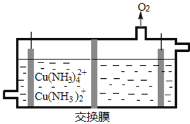
(3)在电解槽中电解氨性含铜蚀刻废液,电解后向阴极液中加入盐酸酸化,再倒入蒸馏水稀释,得到氯化亚铜沉淀。
①电解装置如图所示,阴极区电极方程式为___________________________ 。
②稀释过程中溶液的温度不同,得到沉淀质量和氯化亚铜百分含量变化如图所示。
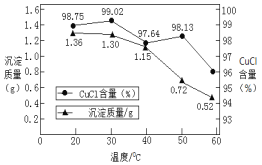
从氯化亚铜产率角度分析,最佳稀释温度为__________________;温度越高得到氯化亚铜沉淀质量越小,其原因可能是:i.加热过程中部分氯化亚铜被氧化;ii.___________________。
【答案】2Cu(CH3O)Cl + CO = (CH3O)CO + 2CuCl –a + b + 2c 溶解 CuCl,防止其覆盖在铜表面阻碍反应进行 ![]() +e–=
+e–=![]() +2NH3 20℃ 温度高CuCl 溶解度增大
+2NH3 20℃ 温度高CuCl 溶解度增大
【解析】
利用总反应减去反应i,便可得到反应ii的化学方程式;借助三个已知热化学方程式,利用盖斯定律,便可求出待求反应的△H;从反应看,Cu、CuCl、CuCl2都呈固态,产物会覆盖在反应物表面,阻止反应的进行,所以加入盐酸便是为了让反应能持续进行;电解后向阴极液中加入盐酸酸化,再倒入蒸馏水稀释,得到氯化亚铜沉淀,说明通过电解,将![]() 转化为
转化为![]() ;在稀释前,沉淀质量为一定值,改变温度、加水稀释,由于溶解度的改变,导致固体质量的改变,所以只要利用图中数据,求出CuCl的质量,便可确定CuCl产率最高的点对应的温度;温度越高得到氯化亚铜沉淀质量越小,原因一个为溶解,一个为变质。
;在稀释前,沉淀质量为一定值,改变温度、加水稀释,由于溶解度的改变,导致固体质量的改变,所以只要利用图中数据,求出CuCl的质量,便可确定CuCl产率最高的点对应的温度;温度越高得到氯化亚铜沉淀质量越小,原因一个为溶解,一个为变质。
(1)将总反应“4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O”减去反应“4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O”,便可得到反应ii为2Cu(CH3O)Cl + CO = (CH3O)CO + 2CuCl。答案为:2Cu(CH3O)Cl + CO = (CH3O)CO + 2CuCl;
2(CH3O)2CO+2H2O”减去反应“4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O”,便可得到反应ii为2Cu(CH3O)Cl + CO = (CH3O)CO + 2CuCl。答案为:2Cu(CH3O)Cl + CO = (CH3O)CO + 2CuCl;
(2)Cu(s)+Cl2(g)=CuCl2(s) △H=-a kJ·mol-1 ①
CuCl2(s) +Cu(s) +4HCl(aq)=2H2[CuCl3] (aq) △H=+b kJ·mol-1 ②
CuCl(s) + 2HCl(aq)H2[CuCl3] (aq) △H=-c kJ·mol-1 ③
①利用盖斯定律,将反应①+②-③×2得,反应 2Cu(s)+Cl2(g)=2CuCl(s) △H=–a + b + 2c kJ·mol-1。答案为:–a + b + 2c;
②向CuCl2 溶液中加入过量铜粉,发生反应生成CuC1,由于反应生成的CuCl覆盖在Cu表面,阻止反应的不断进行,所以在实验过程中要加入浓盐酸反应才能持续进行,加入浓盐酸的目的是:溶解 CuCl,防止其覆盖在铜表面阻碍反应进行。答案为:溶解 CuCl,防止其覆盖在铜表面阻碍反应进行;
(3)①电解后向阴极液中加入盐酸酸化,再倒入蒸馏水稀释,得到氯化亚铜沉淀,则表明![]() 转化为
转化为![]() ,阴极区电极方程式为
,阴极区电极方程式为![]() +e–=
+e–=![]() +2NH3。 答案为:
+2NH3。 答案为:![]() +e–=
+e–=![]() +2NH3;
+2NH3;
②反应所得固体的质量相同,所含CuCl的质量相同,但由于稀释过程中溶液的温度不同,得到沉淀质量和氯化亚铜百分含量不同。在20℃时,CuCl2的质量为1.36g×98.75%=1.343g,30℃时,CuCl2的质量为1.30g×99.02%=1.287g,CuCl2的质量越大,产率越高,所以从氯化亚铜产率角度分析,最佳稀释温度为20℃;温度越高得到氯化亚铜沉淀质量越小,可从溶解度和被氧化两个方面分析,所以其原因可能是:i.加热过程中部分氯化亚铜被氧化;ii.温度高CuCl 溶解度增大。答案为:20℃;温度高CuCl 溶解度增大。

 阅读快车系列答案
阅读快车系列答案【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向蛋白质溶液中加入醋酸铅溶液,产生白色沉淀 | 蛋白质发生了盐析 |
B | SO2通入Ba(NO3)2溶液中,产生白色沉淀 | 沉淀为BaSO3 |
C | 向蔗糖中加入适量浓硫酸并搅拌,蔗糖变黑,体积膨胀,并放出刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
D | 分别向等物质的量浓度的苯酚钠溶液和碳酸钠溶液中滴加酚酞,后者红色更深 | 碳酸酸性强于苯酚 |
A.AB.BC.CD.D