题目内容
一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池, 2CH3OH + 3O2 + 4OH-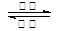 2CO32- + 6H2O,则下列说法正确的是
2CO32- + 6H2O,则下列说法正确的是
| A.构成该电池的正极和负极必须是两种活性不同的金属 |
| B.充电时有CH3OH生成的电极为阳极 |
| C.放电时溶液中的OH- 移向正极 |
| D.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32- + 6H2O |
D
解析试题分析:A.燃料电池的电极可以是石墨,所以构成该电池的正极和负极可能是石墨,故A错误;B.充电时,碳酸根离子得电子生成甲醇,则有CH3OH生成的电极为阴极,故B错误;C.放电时溶液中的OH- 移向负极,故C错误.D.放电时,负极上甲醇失电子发生氧化反应,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故D正确;故选D.
考点:考查了原电池和电解池原理

下列有关实验的叙述中,合理的是
| A.把SO2通入紫色石蕊试液,可验证SO2的漂白性 |
B.构成如图所示装置时,盐桥中的K+向左池移动 |
| C.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高 |
| D.将l0 克 ZnSO4·7H2O溶解在90克水中配制10%的ZnSO4溶液 |
下列有关电化学装置的说法正确的是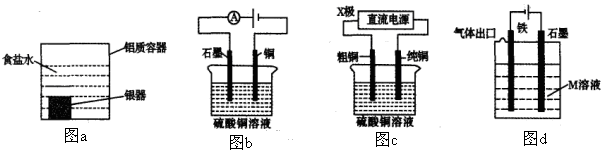
| A.利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-=2Ag+S2- |
| B.图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出 |
| C.图c中的X极若为负极,则该装置可实现粗铜的精炼 |
| D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
下列描述中,不符合生产实际的是
| A.电解法精炼粗铜,用纯铜作阴极 |
| B.电解熔融的氯化钠制取金属钠,用铁作阳极 |
| C.在镀件上电镀锌,用锌作阳极 |
| D.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
控制适宜条件,将反应Sn(s)+Pb2+ (aq) Sn2+ (aq)+Pb(s) △H<0,设计成如下图所示的原电池,一段时间后,灵敏电流计读数为零。则下列判断不正确的是( )
Sn2+ (aq)+Pb(s) △H<0,设计成如下图所示的原电池,一段时间后,灵敏电流计读数为零。则下列判断不正确的是( )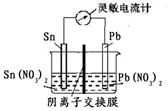
| A.此时化学反应达到平衡状态 |
| B.若此时将Sn电极换成质量较大的Sn 电极后,电流计指针偏转,c(Pb2+)将减小 |
| C.若此时向左池加入少量的Sn(NO3)2固体,电流计指针偏转,Sn电极为正极 |
| D.若此时升高温度,c(Sn2+)将减小,Pb电极为负极 |
目前人们掌握了可充电锌—空气电池技术,使这种电池有了更广泛的用途。这种电池使用特殊技术吸附空气中的氧,以苛性钠为电解质,电池放电时的总反应为2Zn+O2 2ZnO,下列判断正确的是( )
2ZnO,下列判断正确的是( )
| A.放电时,OH-向负极方向移动 |
B.放电时,正极反应式为Zn+2OH--2e- ZnO+H2O ZnO+H2O |
| C.充电时,Zn发生氧化反应 |
D.充电时,阴极反应为O2+2H2O+4e- 4OH- 4OH- |
Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )。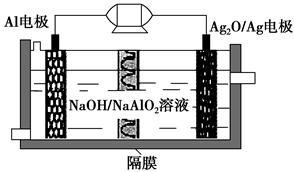
| A.工作时正极发生还原反应 |
| B.当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol |
| C.Al电极的反应式为Al-3e-+4OH-=AlO2—+2H2O |
| D.工作时电解液中的Na+透过隔膜移向Al电极 |
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O电解,Al2O3+3H2↑
电解过程中,以下判断正确的是 ( )。
| | 电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3 mol Pb | 生成2 mol Al2O3 |
| C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:3Al+3H2O-6e-=Al2O3+6H+ |
| D | 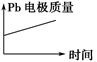 |  |
如图是某固体酸燃料电池基本结构示意图,其中以Ca(HSO4)2固体为电解质传递H+,电池总反应式为:2H2+O2=2H2O,下列有关说法不正确的是( )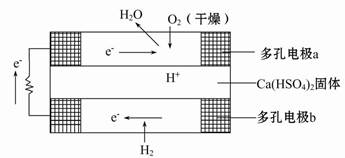
| A.H2通过多孔电极时能增大H2的接触面积,加快反应 |
| B.a极上的电极反应式为:O2+2H2O+4e-=4OH- |
| C.每转移0.1 mol电子,消耗标准状况下的H2 1.12 L |
| D.H+由b极通过固体酸电解质传递到a极 |