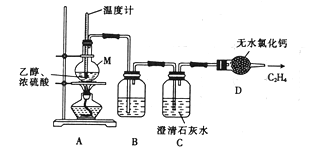
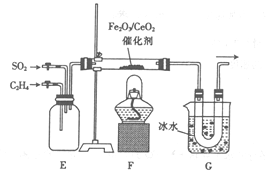
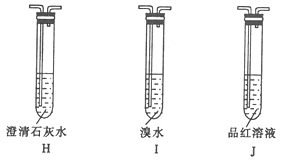
题目内容
【题目】(1)硫元素位于元素周期表第____列;硫元素原子核外有2个未成对电子,这2个电子所处亚层的符号是_______;硫、氯元素的原子均可形成与Ar原子电子层结构相同的简单离子,且硫离子的半径更大,请解释__________________。
(2)S8和P4的分子中都只有共价单键,若P4分子中有6个P-P键,则可推断S8分子有___个S-S键;已知:H-S键键能:339 kJ/mol;H-Se键键能:314 kJ/mol。以上键能数据能否比较S、Se非金属性的强弱______(选填“能”、“否”;下同);能否比较H2S、H2Se沸点的高低______。
(3)在25℃,Na2SO3溶液吸收SO2得到的NaHSO3溶液中c(SO32-)>c (H2SO3),据此判断NaHSO3溶液显___性。
(4)在25℃,Na2SO3溶液吸收SO2后,若溶液pH=7.2,则溶液中c(SO32-)=c (HSO3-);若溶液pH=7,则以下浓度关系正确的是(选填编号)___________。
a.c(Na+) = 2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)已知Na2SO3溶液中存在水解平衡:SO32-+H2O![]() HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是__________,操作和现象是__________________。
HSO3-+OH-,请用Na2SO3溶液和a试剂及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程。a试剂是__________,操作和现象是__________________。
【答案】 16 3p 氯离子核电荷数更大,对外层电子的引力更强,故离子半径较硫离子小。 8 能 否 酸 ab 酚酞 取样品溶于水,滴加酚酞显红色,加热后溶液红色加深
【解析】(1)硫元素位于元素周期表第16列;硫元素原子核外有2个未成对电子,这2个电子所处亚层的符号是3p;由于氯离子核电荷数更大,对外层电子的引力更强,故离子半径较硫离子小。(2)因为S8的分子中都只有共价单键,所以结构模型为![]() ,所以S8分子有8个S-S键;共价键的键能越大氢化物越稳定,中心元素的非金属性越强,H2S、H2Se沸点的高低无键能的大小无关,与分子间作用力的大小有关。(3)在25℃,Na2SO3溶液吸收SO2得到的NaHSO3溶液中c(SO32-)>c (H2SO3),这说明亚硫酸氢根的电离程度大于水解程度,NaHSO3溶液显酸性。(4)a.溶液pH=7,溶液显中性,根据电荷守恒c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)可知c(Na+) = 2c(SO32-)+c(HSO3-),a正确;b.亚硫酸氢根的电离程度或水解程度均较小,则溶液中c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-),b正确;c.根据电荷守恒c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)可知c错误,答案选ab;(5)已知Na2SO3溶液中存在水解平衡:SO32-+H2O
,所以S8分子有8个S-S键;共价键的键能越大氢化物越稳定,中心元素的非金属性越强,H2S、H2Se沸点的高低无键能的大小无关,与分子间作用力的大小有关。(3)在25℃,Na2SO3溶液吸收SO2得到的NaHSO3溶液中c(SO32-)>c (H2SO3),这说明亚硫酸氢根的电离程度大于水解程度,NaHSO3溶液显酸性。(4)a.溶液pH=7,溶液显中性,根据电荷守恒c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)可知c(Na+) = 2c(SO32-)+c(HSO3-),a正确;b.亚硫酸氢根的电离程度或水解程度均较小,则溶液中c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-),b正确;c.根据电荷守恒c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)可知c错误,答案选ab;(5)已知Na2SO3溶液中存在水解平衡:SO32-+H2O![]() HSO3-+OH-,即水解溶液显碱性,因此可以用酚酞试液检验,操作和现象是:取样品溶于水,滴加酚酞显红色,加热后溶液红色加深,说明水解吸热。
HSO3-+OH-,即水解溶液显碱性,因此可以用酚酞试液检验,操作和现象是:取样品溶于水,滴加酚酞显红色,加热后溶液红色加深,说明水解吸热。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】下列有机物命名及其一氯代物的同分异构体数目正确的是
命名 | 一氯代物 | |
A | 2-甲基-2-乙基丙烷 | 4 |
B | 1,3-二甲基苯 | 3 |
C | 2,2,3-三甲基戊烷 | 6 |
D | 2,3 -二甲基- 4-乙基己烷 | 7 |
A. A B. B C. C D. D