题目内容
【题目】已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
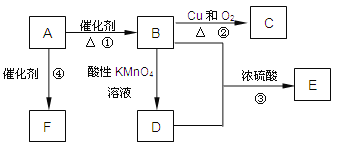
(1)F的结构简式为__________,C的名称为__________。
(2)使1molA与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是_______mol;
(3)写出下列反应的化学方程式:
②__________________________________________________________;
③__________________________________________________________;
④__________________________________________________________;
【答案】![]() 乙醛 5mol 2CH3CH2OH+O2
乙醛 5mol 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOH+CH3CH2OH
2CH3CHO+2H2O CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O ![]()
【解析】
根据有机物的性质和转化关系,分析解答。
(1)衡量一个国家石油化工发展水平的有机原料A是CH2=CH2,高聚物F是![]() 。从反应②的条件看,B是CH3CH2OH、C是CH3CHO(乙醛);
。从反应②的条件看,B是CH3CH2OH、C是CH3CHO(乙醛);
(2)1molCH2=CH2与1molCl2发生加成反应生成1molClCH2CH2Cl,在光照的条件下1molClCH2CH2Cl发生完全取代反应需要4molCl2,则两个过程中消耗的氯气共5mol;
(3)酸性KMnO4溶液直接将B(CH3CH2OH)氧化为D(CH3COOH),则E为乙酸乙酯。有关化学方程式为:
②2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
③CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④![]()

 阅读快车系列答案
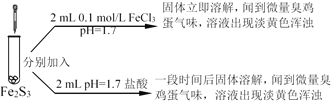
阅读快车系列答案【题目】某小组研究FeCl3与Na2S的反应,设计了如下实验:
| 实验a | 实验b | 实验c | |
FeCl3 体积 | 5 mL | 10 mL | 30 mL | |
实验 现象 | 产生黑色浑浊,混合液pH=11.7 | 黑色浑浊度增大,混合液pH=6.8 | 黑色浑浊比实验b明显减少,观察到大量黄色浑浊物,混合液pH=3.7 |
I. 探究黑色沉淀的成分
查阅资料:Fe2S3(黑色)在空气中能够稳定存在,FeS(黑色)在空气中易变质为Fe(OH)3
设计实验:分别取实验a、b、c中沉淀放置于空气中12小时,a中沉淀无明显变化。
b、c中黑色沉淀部分变为红褐色。
(1)① 同学甲认为实验a中黑色沉淀为Fe2S3,实验b、c的黑色沉淀物中既有Fe2S3又有FeS,依据的实验现象是________。
② 同学乙认为实验b的黑色沉淀物中有FeS则一定混有S,理由是_________。
③ 设计实验检验b的黑色沉淀物中混有硫。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
已知:硫在酒精溶液中的溶解度随乙醇质量分数的增大而增大。
实验证明了b中黑色沉淀混有S,试剂a是_____,观察到的现象为_____。
II. 探究实验a中Fe3+与S2-没有发生氧化还原反应的原因
经查阅资料,可能的原因有两种:
原因1:pH影响了Fe3+与S2-的性质,二者不能发生氧化还原反应。
原因2:沉淀反应先于氧化还原反应发生,导致反应物浓度下降,二者不能发生氧化还原反应。
设计实验:电极材料为石墨
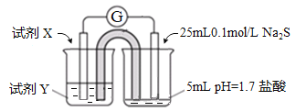
(2)①试剂X和Y分别是__________
②甲认为若右侧溶液变浑浊,说明Fe3+与S2-发生了氧化还原反应。是否合理?说明理由_______。
③乙进一步实验证明该装置中Fe3+与S2-没有发生氧化还原反应,实验操作及现象是_______。
④由此得出的实验结论是__________。
III. 探究实验c随着FeCl3溶液的增加,黑色沉淀溶解的原因
实验1 | 实验2 |
|
|
(3)①用离子方程式解释实验1中的现象_________、_________(写离子方程式)。
②结合化学平衡等反应原理及规律解释实验2中现象相同与不同的原因______。