题目内容
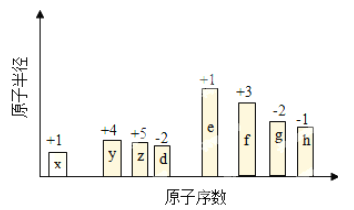
【题目】随原子序数递增,八种短周期元素(用字母x……表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
回答下列问题:
(1)H的离子结构示意图为__________________________。
(2)由E和D两元素形成的原子个数比为1∶1的化合物的电子式为______________。
(3)单质G易溶于YG2,则YG2的结构式为_______________。
(4)Z2X4是一种高效清洁的火箭燃料,8g该物质含有的共用电子对数目为_____________。
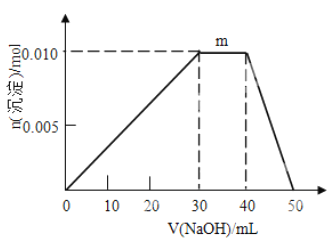
(5)上述元素可组成盐R:ZX4F(GD4)2。向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化如图所示,则m点对应的离子方程式为_____________。
【答案】 ![]()
![]() S=C=S 1.25 NA(或1.25×6.02×1023) NH4++OH-=NH3H2O
S=C=S 1.25 NA(或1.25×6.02×1023) NH4++OH-=NH3H2O
【解析】从图中原子半径的相对大小、最高正价或最低负价及原子序数可知:X―H元素, Y―C元素 ,Z―N元素 ,D―O元素 ,E―Na元素, F―Al元素, G―S元素 ,H―Cl元素
(1)H的离子Cl― 结构示意图为![]() ;(2)由E和D两元素形成的原子个数比为1∶1的化合物Na2O2的电子式为
;(2)由E和D两元素形成的原子个数比为1∶1的化合物Na2O2的电子式为![]() ;(3)单质G易溶于YG2,即S易溶于CS2,则YG2的结构式为S=C=S;
;(3)单质G易溶于YG2,即S易溶于CS2,则YG2的结构式为S=C=S;
(4)N2H4+O2=N2+2H2O 转移电子
1mol 4mol
8/32mol n
n=1.25mol
(5)上述元素可组成盐R:NH4Al(SO4)2 与NaOH反应的图可知:三个阶段的反应及现象分别是:白色沉淀:2NH4Al(SO4)2 + 6NaOH ![]() 3Na2SO4 + (NH4)2SO4 +Al(OH)3↓,刺激性气味:2NaOH + (NH4)2SO4
3Na2SO4 + (NH4)2SO4 +Al(OH)3↓,刺激性气味:2NaOH + (NH4)2SO4 ![]() Na2SO4 + 2H2O + 2NH3↑,Al(OH)3 + NaOH
Na2SO4 + 2H2O + 2NH3↑,Al(OH)3 + NaOH ![]() NaAlO2 + 2H2O,故m点对应的离子方程式为NH4++OH-=NH3H2O。
NaAlO2 + 2H2O,故m点对应的离子方程式为NH4++OH-=NH3H2O。

【题目】下表为元素周期表的一部分,请用化学用语回答有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ⑨ | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)①和⑧的元素符号是______和______;
(2)元素⑥形成的氢化物的电子式是______;
(3)表中能形成两性氢氧化物的元素是______(填写元素符号),请写出该元素的氢氧化物与⑨最高价氧化物对应的水化物发生反应的化学方程式_______________________。
