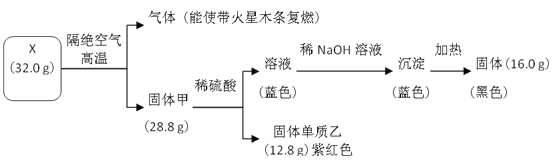
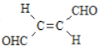��Ŀ����
����Ŀ����������ԭ���ԭ�������˶��ֵ�أ��������ճ���������Ϳ�ѧ�����ȷ������Ҫ������������ṩ����Ϣ���ش��������⡣
��1��Ǧ�����ڷŵ�ʱ�ĵ�ط�ӦΪPb+PbO2+2H2SO4==2PbSO4+2H2O�����������ϵĵ缫��ӦΪ___________��
��2��FeCl3��Һ��ʴӡˢ��·ͭ��ʱ������Ӧ��2FeCl3+Cu==2FeCl2+ CuCl2�������˷�Ӧ��Ƴ�ԭ��أ������õĵ缫����Ϊ_____���缫��Ӧʽ��_________��
��3����Fe��������KOH��Һ���������Һ�����е�⣬�������õ�FeO![]() ��д�������ĵ缫��Ӧʽ____________________________________
��д�������ĵ缫��Ӧʽ____________________________________
��4����֪�״�ȼ�ϵ�صĹ���ԭ������ͼ��ʾ���õ�ع���ʱ��b��ͨ�������Ϊ_____���õ�������ϵĵ缫��ӦʽΪ _______________����6.4g�״�(CH3OH)��ȫ��Ӧ����CO2ʱ����____mol���ӷ���ת�ơ�

���𰸡�PbO2+4H++SO42-+2e- = PbSO4+2H2O Cu Cu-2e����Cu2+ Fe��6e����8OH����FeO![]() ��4H2O CH3OH O2+4H++4e����2H2O 1.2
��4H2O CH3OH O2+4H++4e����2H2O 1.2
��������
����ԭ���ԭ�����ܷ�Ӧ����ʽ��д�缫��Ӧʽ���ж������������ݵ���ԭ�����ŵ�˳����д�缫��Ӧʽ�����ݼ״�ȼ�ϵ�ص�ԭ��������ص����������缫��Ӧʽ�����ݷ�Ӧʽ����ת�Ƶ�������
��1���ŵ�ʱ��PbO2������������ԭ��Ӧ�������ܷ�Ӧ�����������ϵķ�ӦʽΪPbO2+4H++SO42-+2e- = PbSO4+2H2O���ʴ�Ϊ�� PbO2+4H++SO42-+2e- = PbSO4+2H2O��
��2����Ӧ2FeCl3+Cu=2FeCl2+ CuCl2�У�Cuʧȥ���ӷ���������Ӧ��Cu-2e����Cu2+������ԭ����и���������Cu���ʴ�Ϊ��Cu��Cu-2e����Cu2+��
��3����������ʧ���ӣ�����������Ӧ������FeO![]() �����ݵ���غ��жϣ��������Һ��OH-�μӷ�Ӧ����缫��ӦʽΪ��Fe��6e����8OH����FeO
�����ݵ���غ��жϣ��������Һ��OH-�μӷ�Ӧ����缫��ӦʽΪ��Fe��6e����8OH����FeO![]() ��4H2O���ʴ�Ϊ��Fe��6e����8OH����FeO
��4H2O���ʴ�Ϊ��Fe��6e����8OH����FeO![]() ��4H2O��
��4H2O��
��4��ԭ�����H+�������ƶ�������ͼ�������ӵ��ƶ������֪c��һ��ĵ缫Ϊ����������b��һ��ĵ缫�Ǹ������״��ڸ����Ϸ���������Ӧ����b��ͨ�����CH3OH������������������ԭ��Ӧ���õ��ӣ��������ӽ������ˮ���缫��ӦʽΪO2+4H++4e����2H2O�������ϵĵ缫��ӦΪCH3OH+H2O-6e-=6H++CO2��6.4g�״�(CH3OH)�����ʵ���Ϊ![]() ����ȫ��Ӧ����CO2ʱ��ת�Ƶ��ӵ����ʵ���Ϊ0.2mol��6=1.2mol��
����ȫ��Ӧ����CO2ʱ��ת�Ƶ��ӵ����ʵ���Ϊ0.2mol��6=1.2mol��
�ʴ�Ϊ��CH3OH��O2+4H++4e����2H2O��1.2��

����Ŀ������˵����ȷ���ǣ� ��
A.��״���£���![]()
![]() �Ĵ�����Һ�м�������ƾ��壬�����Һ��
�Ĵ�����Һ�м�������ƾ��壬�����Һ��![]() �������Һ��
�������Һ��![]()
B.�����±����йع��ۼ��ļ��ܣ�
���ۼ� |
|
|
|
|
���� | 348 | 610 | 413 | 436 |
���Լ������Ӧ��![]()
![]()
![]()
![]() ��
��![]()
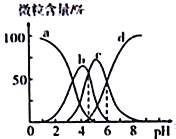
C.һ�����ĸ���![]() ��Һ����μ���
��Һ����μ���![]() ��Һ����ijһʱ�̣���Ӧ�����ӷ���ʽ������
��Һ����ijһʱ�̣���Ӧ�����ӷ���ʽ������![]()
D.��֪��![]() ��
�� ������¶��µı���
������¶��µı���![]() ��Һ�м���һ�����������ƻ��Ȼ��������ʹ
��Һ�м���һ�����������ƻ��Ȼ��������ʹ![]() ����
����