题目内容
某反应体系中的物质有:SnCl2、H3AsO3、H2SnCl6、As、HCl、H2O。已知H3AsO3在酸性介质中以氧化性为主。(1) 请将另外5种物质分别填入下面的横线上,配平该反应的化学方程式并标出电子转移的方向和数目
→ As+
(2) 反应中,被氧化的物质是 ,得到1mol还原产物,转移电子 个。
(3) 又知H3AsO3在碱性介质中以还原性为主。如pH =8时,H3AsO3能使I2的淀粉溶液褪色,H3AsO3被氧化为AsO43-,则还原剂与氧化剂物质的量之比为 。
(1)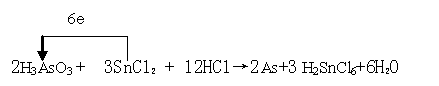
(方程式 1分,配平 1分,电子转移方向与数目 2分)
(2) SnCl2 , 3×6.02×1023 (每空1分,共2分) (3)1:1 (2分)

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
