题目内容
(8分)增加反应物浓度可以加快化学反应速率。已知:反应Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O出现浑浊的快慢与浓度有关。现有0.1mol/L的Na2S2O3溶液和0.1mol/L的H2SO4溶液和蒸馏水;实验用品有:烧杯、试管、量筒、胶头滴管、秒表等,请设计一个实验通过较明显的实验事实证明上述结论(说明实验操作、现象及结论)。
取两支试管,在试管A中加入0.1mol/L的硫酸溶液10mL,在试管B中加入0.1mol/L的硫酸和水各5mL,然后分别加入10mL0.1mol/L的Na2S2O3溶液,并记录开始出现浑浊现象的时间。现象:试管A中先出现浑浊。结论:浓度大的出现浑浊所需时间短,因而反应速率快。
解析:取两支试管,在试管A中加入0.1mol/L的硫酸溶液10mL,在试管B中加入0.1mol/L的硫酸和水各5mL,然后分别加入10mL0.1mol/L的Na2S2O3溶液,并记录开始出现浑浊现象的时间。现象:试管A中先出现浑浊。结论:浓度大的出现浑浊所需时间短,因而反应速率快。

 名校课堂系列答案
名校课堂系列答案(08长沙雅礼中学一模)(16分)某课外实验小组学生利用下图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO。(图中夹持装置已略去)
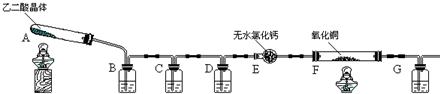 |
(1)装置C中盛放 溶液;D的作用是 ;
(2)证明分解产物中有CO的现象是 ;
(3)该装置有一个不足之处,请写出 ;
(4)某同学查阅相关资料:草酸是二元酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。因此该同学认为:需要在装置B之前增加一个装有________(填写下列编号字母)的洗气装置。
a.水 b.NaOH 溶液 c.Na2CO3 溶液 d.饱和NaHCO3 溶液
(5)草酸可以在酸性条件下被KMnO4氧化,反应的离子方程式为:
2MnO4- + 5H2C2O4 +6 H+ = 2Mn2+ +10 CO2↑+8 H2O
实验室常用草酸钠标定KMnO4溶液。操作如下:准确称取2.680 g草酸钠,放入锥形瓶中,加100 mL稀硫酸溶解,将锥形瓶置于 (填“酸式” “碱式”)滴定管下,用KMnO4溶液滴定。当 时,即达到滴定终点。重复上述滴定操作三次,实验数据如下表所示。
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | 第四次终点 |
滴定管 液面刻度 | 0.00 mL | 20.02 mL | 21.00mL | 19.98 mL | 20.00mL |
KMnO4溶液的物质的量浓度的是c(KMnO4)= mol?L-1。
 (2011?肇庆二模)二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
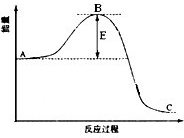
(2011?肇庆二模)二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.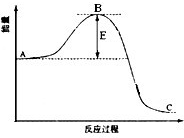 合成氨反应过程中的能量变化如图所示,据图回答下列问题:
合成氨反应过程中的能量变化如图所示,据图回答下列问题: