题目内容
2.根据图中反应,写出各物质的化学式及①②③反应的化学方程式.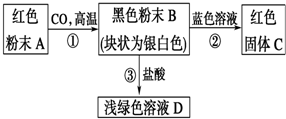
(1)A是Fe2O3,B是Fe,C是Cu,D是FeCl2.
(2)化学方程式:①Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2;②Fe+CuSO4═FeSO4+Cu③Fe+2HCl═FeCl2+H2↑.
分析 红色粉末A与CO在高温下生成黑色粉末B,块状为银白色,则A为Fe2O3,B为Fe,Fe与蓝色溶液反应生成红色固体,则蓝色溶液应为含有铜离子的盐,常见的为硫酸铜溶液,C为Cu,铁与盐酸反应生成浅绿色溶液D为FeCl2,据此答题.
解答 解:红色粉末A与CO在高温下生成黑色粉末B,块状为银白色,则A为Fe2O3,B为Fe,Fe与蓝色溶液反应生成红色固体,则蓝色溶液应为含有铜离子的盐,常见的为硫酸铜溶液,C为Cu,铁与盐酸反应生成浅绿色溶液D为FeCl2,
(1)根据上面的分析可知,A为Fe2O3,B为Fe,C为Cu,D为FeCl2,
故答案为:Fe2O3;Fe;Cu;FeCl2;
(2)①的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2,②的化学方程式为Fe+CuSO4═FeSO4+Cu,③的化学方程式为Fe+2HCl═FeCl2+H2↑,
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2;Fe+CuSO4═FeSO4+Cu;Fe+2HCl═FeCl2+H2↑.
点评 本题考查无机物的推断与性质,根据物质的颜色进行推断是本题的突破口,要求学生能记住一些物质的特殊颜色和特殊的化学反应,题目难度中等.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
14.下列各组中两种气体的分子数一定相等的是( )
| A. | 温度相同、体积相同的O2和N2 | B. | 质量相等、密度不等的N2和C2H4 | ||
| C. | 体积相同、密度不等的CO和C2H4 | D. | 压强相同、体积相同的O2和H2 |
14.下列溶液中能大量共存的微粒的是( )
| A. | 水电离出的C(H+)=10-13mol/L的溶液中K+、NO3-、Br-、Cl- | |
| B. | 含有大量NO3-的水溶液:I-、Fe3+、H+、Na+ | |
| C. | 弱碱性溶液中HCO3-、NH4+、C2H5O-、MnO4- | |
| D. | 无色透明溶液中:Ba2+、S2-、Cu2+、AlO2- |
11.X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6,下列说法正确的是( )
| A. | Y、Z元素最高价氧化物对应的水化物酸性较强的为H2ZO4 | |
| B. | 离子半径由大到小的顺序为:W>Z>Y | |
| C. | X、Z两种元素的气态氢化物中,X的气态氢化物较稳定,因为X的氢化物分子间有氢键 | |
| D. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
12.氢氧燃料电池是一种新能源.图为氢氧燃料电池示意图.下列说法不正确的是( )
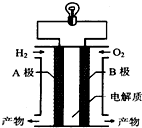

| A. | 电子由B极通过导线流向A极 | |
| B. | A极是负极,B极是正极 | |
| C. | 该装置能将化学能转化为电能 | |
| D. | 产物为无污染的水,属于环境友好电池 |
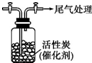 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2在常温下为无色液体,极易水解,遇潮湿空气会产生白雾.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2在常温下为无色液体,极易水解,遇潮湿空气会产生白雾. Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.