题目内容
【题目】汽车尾气和燃煤造成空气污染。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
写出该反应平衡常数表达式:K=__________。
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)________V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是__________。
A. 容器中密度不变
B. 容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2) :v(H2) =1:3
E.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
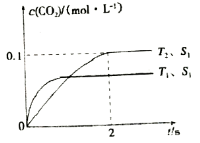
①在T2温度下,0~2 s内的平均反应速率v(N2)=__________;
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1〉S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线。
(3)工业上用CO和H2合成 CH3OH:CO (g) +2H2 (g) ![]() CH3OH (g)
CH3OH (g)
①现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是____________
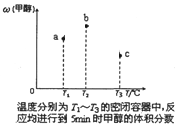
A.正反应的△H>0
B.反应进行到5 min时,b容器中v正=v逆
C.减压可使甲醇的含量由b点变成c点
D.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为__________。
【答案】
(1)①![]() ;< ;②BCE ;
;< ;②BCE ;
(2)①0.025mol /(L·s) ;
② ;
;
(3)①c;②45%;
【解析】
试题分析:(1)①该反应平衡常数表达式为K=![]() ,向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,则
,向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,则
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
开始(mol/L) 1 0.7 0 0
反应 0.2 0.6 0.1 0.3
某状态 0.8 0.1 0.1 0.3
Qc=![]() =
=![]() ×104>K=1,反应向逆反应方向进行,此时V (正)<V (逆),故答案为:
×104>K=1,反应向逆反应方向进行,此时V (正)<V (逆),故答案为:![]() ;<;
;<;
②A.反应过程中气体的质量和体积均不变,容器中气体的密度始终不变,不能判断是否达到化学平衡状态,错误;B.该反应属于气体体积发生变化的反应,容器内压强保持不变,说明气体的物质的量不变,能够说明达到化学平衡状态,正确;C.该反应属于气体体积发生变化的反应,气体质量保持不变,因此平均摩尔质量保持不变,能够说明达到化学平衡状态,正确;D.任何时刻,都存在v(CO2) :v(H2) =1:3,不能判断是否达到化学平衡状态,错误;E.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚,不是正逆反应速率相等,能够说明达到化学平衡状态,正确;F.△H与是否为平衡状态无关,不能判断是否达到化学平衡状态,错误;故选BCE;
(2)①由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.1mol/L,故v(CO2)=![]() 0.05mol/(Ls),速率之比等于化学计量数之比,故v(N2)=0.5v(CO2)=0.5×0.05mol/(Ls)=0.025mol/(Ls),故答案为:0.025mol/(Ls);
0.05mol/(Ls),速率之比等于化学计量数之比,故v(N2)=0.5v(CO2)=0.5×0.05mol/(Ls)=0.025mol/(Ls),故答案为:0.025mol/(Ls);
②接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同,故c(CO2)在T1、S2条件下达到平衡过程中的变化曲线为: ,故答案为:
,故答案为: ;
;
(3)①a.升高温度,甲醇的百分含量减小,说明正反应是放热反应,则△H<0,故A错误;b.反应进行到5min时,a容器的反应如达到平衡,升高温度,平衡向逆向移动,甲醇的体积分数应减小,但图象中给出的是增大,说明还没有达到平衡状态,则v(正)≠v(逆),故B错误;c.b中的平衡状态转变成c中的平衡状态,甲醇的体积分数减小,说明平衡逆向移动,又知反应物的化学计量数之和大于生成物的,应是减小压强,平衡逆向移动,故C正确;d.达到平衡时,a
②平衡状态压强比(P后/P前)=0.70,则反应后气体的物质的量=3mol×0.70=2.10mol,气体减少的物质的量=3mol-2.1mol=0.9mol,根据气体减少的物质的量与氢气之间的关系式知参加反应的CO的物质的量![]() =0.45mol,则CO的转化率=
=0.45mol,则CO的转化率=![]() ×100%=45%,故答案为:45%。
×100%=45%,故答案为:45%。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案