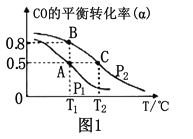
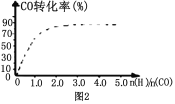
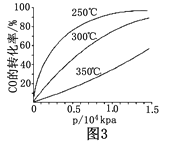
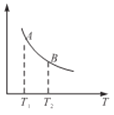
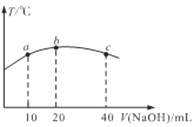
题目内容
【题目】实验是进行化学研究的重要环节,下列有关化学实验的说法正确的是( )
A. 向滴有KSCN的FeCl3溶液中加入NaOH溶液以研究反应物浓度对化学平衡的影响
B. 用酒精萃取碘水中的碘,水从分液漏斗下口放出,碘的酒精溶液从分液漏斗上口倒出
C. 将高锰酸钾溶液装入碱式滴定管中进行滴定实验,以测定某FeSO4样品的纯度
D. 为制备硅酸胶体,以酚酞为指示剂,将浓盐酸滴入饱和Na2SiO3溶液中
【答案】A
【解析】试题分析:A、Fe3++3SCN-![]() Fe(SCN)3,加入氢氧化钠,Fe3+和NaOH生成Fe(OH)3,降低Fe3+的浓度,平衡向正反应方向移动,溶液的颜色变浅,故正确;B、萃取剂选择原则之一是不能与原溶剂互溶,酒精和水任意比例互溶,故错误;C、碱式滴定管只盛放碱性溶液,高锰酸钾溶液具有强氧化性,腐蚀橡胶,因此应用酸式滴定管,故错误;D、制备硅酸胶体不需要用酚酞作指示剂,故错误。
Fe(SCN)3,加入氢氧化钠,Fe3+和NaOH生成Fe(OH)3,降低Fe3+的浓度,平衡向正反应方向移动,溶液的颜色变浅,故正确;B、萃取剂选择原则之一是不能与原溶剂互溶,酒精和水任意比例互溶,故错误;C、碱式滴定管只盛放碱性溶液,高锰酸钾溶液具有强氧化性,腐蚀橡胶,因此应用酸式滴定管,故错误;D、制备硅酸胶体不需要用酚酞作指示剂,故错误。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案【题目】某兴趣小组同学欲研究SO2的相关性质。
(1)比较下表中的两组物质关系,第2组中物质X的化学式是 。
第1组 | 第2组 |
C、CO、CO2、H2CO3、Na2CO3、、NaHCO3、 | S 、SO2、SO3、X、Na2SO4、NaHSO4 |
(2)利用下图装置来检验SO2的性质
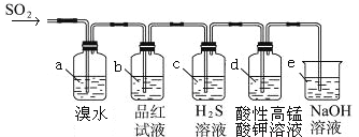
①装置a中的现象是: ; (填“能”或“不能”)说明 SO2 有漂白性
②若装置e中有40 mL 2.5 molL-1 NaOH溶液,反应后增重4.8 g,则装置IV中发生反应的总化学方程式是 。
(3)该小组的甲、乙两位同学利用下图装置继续探究SO2及氯气漂白性:
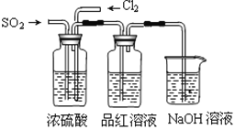
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,用离子方程式表示品红溶液不褪色的原因是: 。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
。