题目内容
【题目】标出下列氧化还原反应过程中有关变化
(1)用单线桥标出电子的转移方向和数目 ,其中氧化剂是 .
NO+N O2+2NaOH═2NaN O2+H2O
(2)用双线桥标出化合价的变化,其中还原剂与氧化剂的物质的量比值是 .
2MnO4﹣+8H++5S O2═2Mn2++5SO42﹣+4H2O.
【答案】
(1)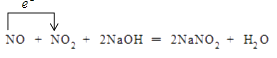 ;NO2
;NO2
(2)5:2
【解析】解:(1)反应NO+NO2+2NaOH═2NaNO2+H2O中,只有N元素化合价发生变化,N元素化合价分别由+2价、+4价变化为+3价,化合价降低值=化合价升高值=转移电子数=1,电子转移方向和数目为: 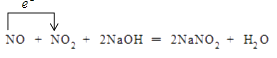 ,NO2得到电子被还原,NO2做氧化剂,
,NO2得到电子被还原,NO2做氧化剂,
所以答案是: 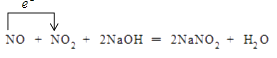 ;NO2;(2)反应2MnO4﹣+8H++5SO2═2Mn2++5SO42﹣+4H2O中,Mn元素化合价由+7价降低到+2价,被还原,MnO4﹣得电子为氧化剂,S元素化合价由+4价升高到+6价,被氧化,SO2失电子为还原剂,还原剂与氧化剂的物质的量之比为 5:2,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为10,用“双线桥法”表示氧化还原反应中电子转移情况为:
;NO2;(2)反应2MnO4﹣+8H++5SO2═2Mn2++5SO42﹣+4H2O中,Mn元素化合价由+7价降低到+2价,被还原,MnO4﹣得电子为氧化剂,S元素化合价由+4价升高到+6价,被氧化,SO2失电子为还原剂,还原剂与氧化剂的物质的量之比为 5:2,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为10,用“双线桥法”表示氧化还原反应中电子转移情况为: 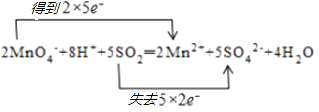 ,
,
所以答案是: 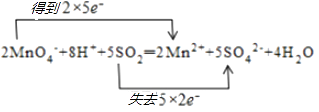 ;5:2.
;5:2.

【题目】某小组同学为探究物质的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
已知:①溴水为溴的水溶液,溴水为橙黄色,溴蒸气为红棕色,均有毒
②氯水为氯气的水溶液。
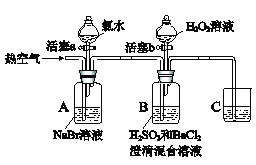
实验记录如下:
实验操作 | 实验现象 | |
Ⅰ | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为橙黄色 |
Ⅱ | 吹入热空气 | A中橙黄色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙黄色 |
请回答下列问题:
(1)A中反应的离子方程式是__________________________________________。
(2)实验操作II吹入热空气的目的是___________________________________。
(3)装置C的作用是_____________________________________。
(4)实验操作III,混合液逐渐变成橙黄色,其对应的离子方程式是____________。
(5)由操作I得出的结论是_____________,由操作III得出的结论是______________。
(6)实验反思:实验操作III,开始时颜色无明显变化的原因是(写出一条即可):___________。
