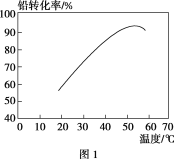
题目内容
【题目】(1)短周期元素W、X、Y、Z、M原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖原子相同。
①M在元素周期表中的位置是__________________________。
②化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_____________。
③(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为_____________。
(2)A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):
![]()
Ⅰ. 若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
①在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为________________
②工业上常用Na2CO3溶液吸收C,生成等物质的量的两种钠盐,该反应的离子方程式为_______________
Ⅱ. A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
①实验室需配制0.1mol·L-1 A溶液450mL。根据计算用托盘天平称取A的质量为__________ g,在实验中其它操作均正确,若定容时仰视刻度线,则所得溶液浓度________________0.1mol·L-1 (填“大于”“等于”或“小于”)。
②将标准状况下2.24L 的W通入150mL 1mol·L-1的A溶液中,充分反应。总反应的离子方程式为_______________
【答案】第三周期 第VIA 族 NH4SCN (CN)2+2OH-=CN-+CNO-+H2O 8NH3+6NO2![]() 7N2+12H2O 2NO2+CO32-==NO3-+NO2-+CO2 2.0 小于 2CO2+3OH-=CO32-+HCO3-+H2O
7N2+12H2O 2NO2+CO32-==NO3-+NO2-+CO2 2.0 小于 2CO2+3OH-=CO32-+HCO3-+H2O
【解析】
(1)短周期元素W、X、Y、Z、M的原子序数依次增大,元素W的一种核素的中子数为0,则W为H元素;X的原子最外层电子数是次外层的2倍,X有2个电子层,最外层电子数为4,X为C元素;Z与M同主族,Z2-电子层结构与氖相同,则Z为O元素、M为S元素;Y的原子序数介于碳、氧之间,则Y为N元素。
①M是S元素,S元素在元素周期表的位置是位于第三周期第VIA族;
②向p溶液中加入FeCl3溶液,溶液变血红色,说明p溶液含有SCN-离子,向p溶液中加入NaOH溶液并加热,放出使湿润的红色石蕊试纸变蓝的气体,说明p中含有NH4+离子,所以p的化学式为NH4SCN;
③(XY)2气体是(CN)2,(CN)2的性质与Cl2相似,(CN)2与NaOH溶液反应的离子方程式为:(CN)2+2OH-=CN-+CNO-+H2O;
(2)I.(1)根据物质之间的转化关系,若A为有刺激性气味的气体,水溶液呈碱性,则A是NH3,B是NO,C为红棕色NO2气体,W是O2,NO2与水反应生成一元强酸D是HNO3,HNO3具有强氧化性。①NH3具有还原性,NO2具有氧化性,二者在催化剂作用下反应可生成N2和H2O,根据电子守恒、原子守恒,可得该反应化学方程式为8NH3+6NO2![]() 7N2+12H2O;②NO2气体是大气污染物,在工业上常用Na2CO3溶液吸收,NO2发生自身的氧化还原反应,生成等物质的量的两种钠盐,该反应的离子方程式为2NO2+CO32-==NO3-+NO2-+CO2;Ⅱ. A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;说明这三种物质都含有钠元素;C常作面包和糕点的发泡剂,受热分解可生成B,C是NaHCO3,B是Na2CO3,则A是NaOH,W是CO2。①实验室没有规格是450mL的容量瓶,根据选择仪器标准 “大而近”的原则,需要配制500mL 0.1mol·L-1 NaOH溶液,选择规格是500mL的容量瓶。n(NaOH)=cV=0.1mol/L×0.5L=0.05mol,其质量是m(NaOH)=nM=0.05mol×40/mol=2.0g。在实验中其它操作均正确,若定容时仰视刻度线,会使配制的溶液的体积偏大,根据
7N2+12H2O;②NO2气体是大气污染物,在工业上常用Na2CO3溶液吸收,NO2发生自身的氧化还原反应,生成等物质的量的两种钠盐,该反应的离子方程式为2NO2+CO32-==NO3-+NO2-+CO2;Ⅱ. A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;说明这三种物质都含有钠元素;C常作面包和糕点的发泡剂,受热分解可生成B,C是NaHCO3,B是Na2CO3,则A是NaOH,W是CO2。①实验室没有规格是450mL的容量瓶,根据选择仪器标准 “大而近”的原则,需要配制500mL 0.1mol·L-1 NaOH溶液,选择规格是500mL的容量瓶。n(NaOH)=cV=0.1mol/L×0.5L=0.05mol,其质量是m(NaOH)=nM=0.05mol×40/mol=2.0g。在实验中其它操作均正确,若定容时仰视刻度线,会使配制的溶液的体积偏大,根据![]() 可知,所得溶液浓度偏小,因此c小于0.1mol/L。②标准状况下2.24L CO2的物质的量是1mol,150mL 1mol·L-1的NaOH溶液中溶质的物质的量是1.5mol,将这些CO2通入该NaOH溶液中,由于n(NaOH):n(CO2)=1.5:1=2:3,所以反应得到等物质的量的碳酸钠、碳酸氢钠和水,反应的离子方程式为2CO2+3OH-=CO32-+HCO3-+H2O。
可知,所得溶液浓度偏小,因此c小于0.1mol/L。②标准状况下2.24L CO2的物质的量是1mol,150mL 1mol·L-1的NaOH溶液中溶质的物质的量是1.5mol,将这些CO2通入该NaOH溶液中,由于n(NaOH):n(CO2)=1.5:1=2:3,所以反应得到等物质的量的碳酸钠、碳酸氢钠和水,反应的离子方程式为2CO2+3OH-=CO32-+HCO3-+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
I.已知某些化学键的键能数据如下
化学键 | C=O | C—O | C—H | H—H | O—H |
键能/kJ·mol-1 | 745 | 351 | 415 | 436 | 462 |
则CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH = __________ kJ·mol-1
CH3OH(g) + H2O(g) ΔH = __________ kJ·mol-1
II.将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(l)
CH3OCH3(g) + 3H2O(l)
(1)该反应化学平衡常数表达式K = __________。
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图所示:

①该反应的ΔH __________ 0(填“>"或“<”)。
②若温度不变,减小反应投料比[n(H2)/n(CO2)],K值将____(填“增大”、“减小”或“不变”)。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是__________。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
P1 | P2 | P3 | |
I.2.0 mol CO2 6.0 mol H2 | 0.10 mol | 0.04 mol | 0.02 mol |
II.1.0 mol CO22 | X1 | Y1 | Z1 |
III.1.0 mol CH3OCH3 3.0 mol H2O | X2 | Y2 | Z2 |
①P1 __________ P3(填“>”“<”或“=”);
②P2下,III中CH3OCH3的平衡转化率为__________。
【题目】根据下表提供的数据,判断下列离子方程式或化学方程式正确的是
化学式 | 电离常数 |
HClO | K=3×10-8 |
H2CO3 | K1=4×10-7 K2=6×10-11 |
A. 向Na2CO3溶液中滴加少量氯水:![]() +2Cl2+H2O===2Cl-+2HClO+CO2↑
+2Cl2+H2O===2Cl-+2HClO+CO2↑
B. 向NaHCO3溶液中滴加少量氯水:2![]() +Cl2===Cl-+ClO-+2CO2↑+H2O
+Cl2===Cl-+ClO-+2CO2↑+H2O
C. 向NaClO溶液中通少量CO2:CO2+NaClO+H2O===NaHCO3+HClO
D. 向NaClO溶液中通过量CO2:CO2+2NaClO+H2O===Na2CO3+2HClO