题目内容
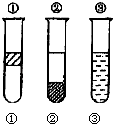
【题目】利用如图所示装置制取氧气并进行相关的实验探究.

(1)将3.9g过氧化钠放入烧瓶中,加入100mLH2O,用排水法收集气体.
①过氧化钠与水反应的化学方程式为:_____________________________;
②集气瓶充满气体后,怎么从水槽中取出集气瓶?简述操作方法__________________________.
(2)已知:酚酞在c(OH-)为1.0×10-4mol/L~2.5mol/L时呈红色,且0.5min内不会褪色;H2O2具有氧化性和漂白性.取上述实验得到的溶液于试管中,滴入2滴酚酞试液,溶液变红,但红色迅速褪去.
①有人认为“红色迅速褪去”是因为溶液中存在H2O2.试设计实验证明烧瓶内的溶液中可能含有H2O2存在,请简述实验操作_____________________________.
②也有人认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的,不考虑反应前后溶液体积变化,试通过估算并对比数据加以说明该理解是否正确? _____________ ,理由是____________。
【答案】 2Na2O2+2H2O=4NaOH+O2↑ 用玻璃片在水面下盖住集气瓶口,将玻璃片与集气瓶一起移出水面,将盖有玻璃片的集气瓶正放在实验台上 取烧瓶中的溶液置于试管中,加入少量MnO2.有气泡放出,用带火星的木条检验,木条复燃,说明溶液中可能有H2O2 不正确 经估算,烧瓶中c(OH-)约为1mol/L;因为“酚酞在c(OH-)为1.0×10-4mol/L~2.5mol/L时呈红色,且0.5min内不会褪色”,因此,“红色迅速褪去”不是因为溶液中c(OH-)过大造成的
【解析】(1)①过氧化钠与水反应生成氢氧化钠和氧气,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;②集气瓶充满气体后,从水槽中取出集气瓶操作方法:用玻璃片在水面下盖住集气瓶口,将玻璃片与集气瓶一起移出水面,将盖有玻璃片的集气瓶正放在实验台上。(2)①如存在H2O2,加入二氧化锰,可生成氧气,方法是取烧瓶中的溶液置于试管中,加入少量MnO2,有气泡放出,用带火星的木条检验,木条复燃,说明溶液中可能有H2O2。②不正确,3.9g过氧化钠的物质的量为:n(Na2O2)=3.9g/78g·mol-1=0.05mol,根据反应2Na2O2+2H2O=4NaOH+O2↑可知,n(NaOH)=0.1mol,c(OH-)=0.1mol/0.1L=1mol·L-1,因为“酚酞在c(OH-)为1.0×10-4mol·L-1~2.5mol·L-1时呈红色,且0.5min内不会褪色”,因此,“红色迅速褪去”不是因为溶液中c(OH-)过大造成的。