题目内容
使0.15mol MnO2与过量的12mol·L-1的浓盐酸反应,使50mL 12mol·L-1的浓盐酸与足量MnO2反应,两者产生的氯气相比(其他条件相同)
| A.一样多 | B.前者较后者多 | C.后者较前者多 | D.无法比较 |
B
试题分析:MnO2与浓盐酸反应的化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。若浓盐酸过量,产生的氯气按照MnO2来计算。n(Cl2)=n(MnO2)= 0.15mol;若足量MnO2,发生应该以参加反应的HCl为标准。n(HCl)=0.05L×12mol/L=0.6mol。若HCl完全反应,放出的氯气的物质的量为HCl的1/4,即是0.15mol.但是只有浓盐酸才发生上述反应。随着反应的进行,盐酸变稀,这时反应不再进行,因此放出的氯气的物质的量小于0.15mol.。故前者较后者多。选项为B。
MnCl2+Cl2↑+2H2O。若浓盐酸过量,产生的氯气按照MnO2来计算。n(Cl2)=n(MnO2)= 0.15mol;若足量MnO2,发生应该以参加反应的HCl为标准。n(HCl)=0.05L×12mol/L=0.6mol。若HCl完全反应,放出的氯气的物质的量为HCl的1/4,即是0.15mol.但是只有浓盐酸才发生上述反应。随着反应的进行,盐酸变稀,这时反应不再进行,因此放出的氯气的物质的量小于0.15mol.。故前者较后者多。选项为B。
练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目

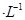 的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。
的溶液缓缓通入100 mLCl2(标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl2,溶液黄色加深,变为棕黄色。

