题目内容
(18分)钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钒钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:

⑴电解食盐水时,总反应的离子方程式_____________________________________。
⑵写出钛铁矿经氯化法得到四氯化钛的化学方程式:___________________。
⑶已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH____________________
反应 在Ar气氛中进行的理由是____________________。
在Ar气氛中进行的理由是____________________。
⑷在上述产业链中,合成192 t甲醇理论上需额外补充H2__________t(不考虑生产过程中物质的任何损失)。
⑸以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是____________________________________________。
(6)已知2A2(g)+B2(g) 2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
①比较a____________b(填>、=、<)
②此反应的平衡常数表达式为________________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)
③能说明该反应已经达到平衡状态的是______。

⑴电解食盐水时,总反应的离子方程式_____________________________________。
⑵写出钛铁矿经氯化法得到四氯化钛的化学方程式:___________________。
⑶已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH____________________
反应
 在Ar气氛中进行的理由是____________________。
在Ar气氛中进行的理由是____________________。⑷在上述产业链中,合成192 t甲醇理论上需额外补充H2__________t(不考虑生产过程中物质的任何损失)。
⑸以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是____________________________________________。
(6)已知2A2(g)+B2(g)
 2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H="-a" kJ/mol(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。①比较a____________b(填>、=、<)
②此反应的平衡常数表达式为________________________;若将反应温度升高到700℃,反应的平衡常数将_____________(增大、减小或不变)
③能说明该反应已经达到平衡状态的是______。
| A.v(C3)=2v(B2) | B.容器内压强保持不变 |
| C.v逆(A2)=2v正(B2) | D.容器内的密度保持不变 |
⑴2Cl-+2H2O 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
⑵2FeTiO3+6C+7Cl2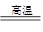 2TiCl4+2FeCl3+6CO;
2TiCl4+2FeCl3+6CO;
⑶-512 kJ?mol-1 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)反应; ⑷10;
⑸CH3OH+8OH--6e—=CO32-+6H2O (6)①> ② ,减小③b c
,减小③b c
 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;⑵2FeTiO3+6C+7Cl2
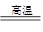 2TiCl4+2FeCl3+6CO;
2TiCl4+2FeCl3+6CO;⑶-512 kJ?mol-1 防止高温下Mg(Ti)与空气中的O2(或CO2、N2)反应; ⑷10;
⑸CH3OH+8OH--6e—=CO32-+6H2O (6)①> ②
 ,减小③b c
,减小③b c(1)惰性电极电解饱和食盐水的生成物是氢气、氢氧化钠和氯气,所以方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。
(2)根据反应物和生成物并依据守恒法可以得出反应的方程式为2FeTiO3+6C+7Cl2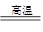 2TiCl4+2FeCl3+6CO。
2TiCl4+2FeCl3+6CO。
(3)根据盖斯定律可知,①×2-②即得到反应2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s),所以反应热是-641 kJ·mol-1×2+770 kJ·mol-1=-512 kJ?mol-1。由于镁或钛都是金属,在高温下易与空气中的O2(或CO2、N2)反应,所以需要在Ar气氛中进行。
(4)192t甲醇是6×106mol,所以需要CO是6×106mol,氢气是12×106mol,。根据(2)中的反应可知,同时需要氯气是7×106mol,则在(1)反应中生成的氢气是7×106mol,所以还需要氢气是5×106mol,质量是10t。
(5)原电池中分解是失去电子的,所以甲醇在负极通入。又因为溶液显碱性,所以负极反应式为CH3OH+8OH--6e—=CO32-+6H2O。
(6)①因为是可逆反应,所以转化率达不到100%,即a大于b。
②平衡常数是指在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,K= 。由于是放热反应,所以温度升高,平衡向逆反应方向移动,平衡常数减小。
。由于是放热反应,所以温度升高,平衡向逆反应方向移动,平衡常数减小。
③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。速率之比是相应的化学计量数之比,因此A中的关系始终是成立,不正确。由于反应是体积减小的,所以压强也是减小,因此B可以说明。C中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,D不正确。答案选BC。
 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。(2)根据反应物和生成物并依据守恒法可以得出反应的方程式为2FeTiO3+6C+7Cl2
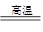 2TiCl4+2FeCl3+6CO。
2TiCl4+2FeCl3+6CO。(3)根据盖斯定律可知,①×2-②即得到反应2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s),所以反应热是-641 kJ·mol-1×2+770 kJ·mol-1=-512 kJ?mol-1。由于镁或钛都是金属,在高温下易与空气中的O2(或CO2、N2)反应,所以需要在Ar气氛中进行。
(4)192t甲醇是6×106mol,所以需要CO是6×106mol,氢气是12×106mol,。根据(2)中的反应可知,同时需要氯气是7×106mol,则在(1)反应中生成的氢气是7×106mol,所以还需要氢气是5×106mol,质量是10t。
(5)原电池中分解是失去电子的,所以甲醇在负极通入。又因为溶液显碱性,所以负极反应式为CH3OH+8OH--6e—=CO32-+6H2O。
(6)①因为是可逆反应,所以转化率达不到100%,即a大于b。
②平衡常数是指在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,K=
 。由于是放热反应,所以温度升高,平衡向逆反应方向移动,平衡常数减小。
。由于是放热反应,所以温度升高,平衡向逆反应方向移动,平衡常数减小。③在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。速率之比是相应的化学计量数之比,因此A中的关系始终是成立,不正确。由于反应是体积减小的,所以压强也是减小,因此B可以说明。C中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,D不正确。答案选BC。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目