题目内容
已知氢氟酸(HF)的酸性比氢氰酸(HCN)强,在物质的量浓度均为0.2mol/L的NaF和NaCN混合溶液中,各离子浓度由大到小的顺序是 .
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:氢氟酸(HF)的酸性比氢氰酸(HCN)强,HF比HCN易电离,由盐类水解越弱越水解可知,0.2mol/L的NaF和NaCN混合溶液中,NaCN水解程度大,溶液中c(F-)>c(CN-),水解显示碱性,则c(OH-)>c(H+),据此判断溶液中各离子浓度大小.
解答:
解:盐类水解中,越弱越水解,氢氟酸(HF)的酸性比氢氰酸(HCN)强,则CN-水解程度大于F-离子的水解程度,则混合液中c(F-)>c(CN-),
由于CN-和F-离子的水解,溶液显示碱性,c(OH-)>c(H+),则溶液中离子浓度大小为:c(Na+)>c(F-)>c(CN-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(F-)>c(CN-)>c(OH-)>c(H+).
由于CN-和F-离子的水解,溶液显示碱性,c(OH-)>c(H+),则溶液中离子浓度大小为:c(Na+)>c(F-)>c(CN-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(F-)>c(CN-)>c(OH-)>c(H+).
点评:本题考查了盐的水解原理及其影响、溶液中离子浓度大小比较,题目难度中等,注意掌握盐的水解原理,能够根据电荷守恒、盐的水解原理判断溶液中离子浓度大小,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
某反应过程中体系的能量变化如图所示,下列说法错误的是( )
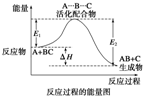

A、反应过程可表示为
| ||||||
| B、E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | ||||||
| C、正反应的热效应为△H=E1-E2<0,所以正反应为放热反应 | ||||||
| D、此图中逆反应的热效应△H=E1-E2<0,所以逆反应为放热反应 |
下列四图中,曲线变化情况与所给反应(a、b、c、d均大于0)相对应的是( )
A、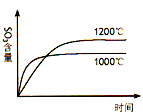 2SO2(g)+O2(g)?2SO3(g)△H=-akJ?mol-1 |
B、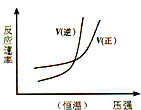 N2(g)+3H2(g)?NH3(g)△H=-bkJ?mol-1 |
C、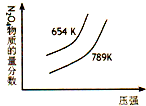 N2O4(g)?2NO2(g)△H=+ckJ?mol-1 |
D、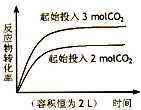 CO2(g)+C(s)?2CO(g)△H=+dkJ?mol-1 |