题目内容
【题目】工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下:
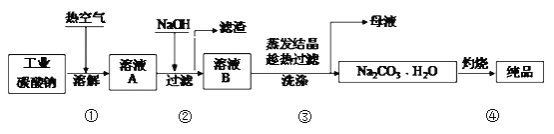
下列说法不正确的是
A. 步骤①,通入热空气可加快溶解速率
B. 步骤②,产生滤渣的离子反应为:Mg2+ + Fe3+ + 5OH- == Mg(OH)2↓+ Fe(OH)3↓
C. 步骤③,趁热过滤时温度控制不当会使Na2CO3H2O中混有Na2CO310H2O等杂质
D. 步骤④,灼烧时用到的主要仪器有铁坩埚、泥三角、三脚架、酒精灯
【答案】B
【解析】碳酸钠中混有Mg2+、Fe2+、Cl-和SO42-等杂质,在溶解时通入热空气可加快溶解速率、促进Fe3+(Fe2+)的水解或氧化Fe2+,加入氢氧化钠,过滤后所得滤渣为氢氧化铁和氢氧化镁,溶液中主要含有碳酸钠,并含有少量的Cl-和SO42-,经蒸发结晶可得碳酸钠晶体,灼烧后可得碳酸钠;A.步骤①,通入热空气因温度升高,则可加快溶解速率,故A正确;B.步骤②,产生滤渣的离子反应因Mg2+ 和Fe3+ 物质的量之比不是1:1,应分开书写,即为:Mg2+ + 2OH- == Mg(OH)2↓,Fe3+ + 3OH- ==Fe(OH)3↓,故B错误;C.步骤③,趁热过滤时如果温度控制不当,Na2CO3H2O中会混有Na2CO310H2O等杂质,故C正确;D.灼烧操作时用到的主要仪器有铁坩埚、泥三角、三脚架、酒精灯,故D正确;答案为B。

【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需的化学元素,其配方如下表:
离子 | K+ | Na+ | Mg2+ | Ca2+ | N03- | H2PO3- | SO42- | Zn2+ |
培养液浓度(mol/L) | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
其中植物根细胞吸收量最少的离子是
A. N03- B. SO42- C. Zn2+ D. H2PO3-