题目内容
浓度为2 mol/L的盐酸溶液V L,欲使其浓度变为4 mol/L,下列方法可行的是
A.通入标况下的HCl气体44.8 L
B.将溶液加热蒸发浓缩至0.5V
C.加入10 mol/L盐酸0.6V L,再将溶液稀释至2V L
D.蒸发掉0.5 L水
【答案】
C
【解析】选项A不正确,因为溶液的体积不是VL;浓盐酸易挥发,加热更易挥发,选项B和D都是不正确的,选项C中盐酸的浓度是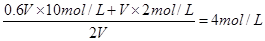 ,因此正确的答案选C。
,因此正确的答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法中正确的是( )
| A、1 mol?L-1的NaCl溶液是指此溶液中含有1 mol NaCl | B、1L 0.5mol?L-1的NaCl溶液中取出100mL溶液,其物质的量浓度变为0.1mol?L-1 | C、6.2gNa2O溶于1L水中所得溶液的物质的量浓度为0.2mol?L-1 | D、1 mol?L-1的CaCl2溶液中,Cl-的物质的量浓度为2 mol?L-1 |
标准状况下分别向甲、乙、丙三个容器中加入30.0mL同浓度的盐酸,再加入不同质量的由两种金属组成的同种合金粉末,测量放出气体的体积.另在甲、乙、丙三个容器中加入30.0mL与盐酸同浓度的氢氧化钠溶液,再分别加入与上述实验相同质量的同种合金,测量放出气体的体积.所得数据如下表所示:
根据表中数据不可能得出的结论是( )
| 反应容器 | 甲 | 乙 | 丙 |
| 合金的质量/g | 0.510 | 1.53 | 3.57 |
| 与盐酸反应产生气体的体积/L | 0.560 | 0.672 | 0.672 |
| 与氢氧化钠反应产生气体的体积/L | 0.336 | x | y |
| A、盐酸的物质的量浓度为2 mol?L-1 |
| B、合金可能由镁与铝组成 |
| C、x=2.016 |
| D、y=2.016 |
