��Ŀ����
����Ŀ��I����һ��2L���ܱ������У�������Ӧ2SO3��g��![]() 2SO2��g��+O2��g������H��0������SO3�ı仯��ͼ��ʾ��
2SO2��g��+O2��g������H��0������SO3�ı仯��ͼ��ʾ��
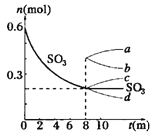
��1����O2��ʾ0��8min�ڸ÷�Ӧ��ƽ������v=__________��
��2�������¶ȣ� Kֵ��__________�������������ƽ����Է���������__________������������������С��������������
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����__________
a��v��SO3��=2v��O2�� b��������ѹǿ���ֲ���
c��v����SO2��=2v����O2�� d���������ܶȱ��ֲ���
��4����8min��ѹ������Ϊ1L����SO3�ı仯����Ϊ__________
A�� a B�� b C�� c D�� d��
II��������A��B�����ݻ�Ϊ2L���ܱ��������������·�Ӧ��4A��g��+B��g��=2C��g����ʼʱ����0.5molB��һ������A����Ӧ���е�4sĩ�����v��B��=0.0125mol��L-1��s-1��A��C��Ϊ0.2mol����
��1��V��A�� =____________
��2����ӦǰA��_________mol
��3��B��ת����Ϊ____________
���𰸡�������1��0.0125 mol/��Lmin����2����
��2������ ��2���� ��С ��2����
��3��b c ��2����
��4��c��2����
������1��0.05 molL-1s-1 ��2���� ��2��0.6 mol ��2���� ��3��20% ��2����
��������
���������������1����O2��ʾ0��8min�ڸ÷�Ӧ��ƽ������v=��0.6-0.3��/2/8=0.0125 mol/��Lmin���� ��2����H��0,�÷�Ӧ���ȣ������¶ȣ� Kֵ��������ƽ�����ƣ������������������䣬���������������������ƽ����Է�����������������3��a��v��SO3��=2v��O2��û�б����棬������b���÷�ӦΪһ������������ķ�Ӧ��������ѹǿ���ֲ��� ����Ӧ��ƽ��״̬����ȷc��v����SO2��=2v����O2�� ������棬�����ʱȺ�ϵ����������������d��������������䣬��Ӧǰ����������������䣬�ܶ�ʼ��Ϊ��ֵ���������ܶȱ��ֲ��䲻����Ϊ�ж�ƽ������ݣ���������ȷ��Ϊb ��c����4����8min��ѹ������Ϊ1L��ƽ�����ƣ�SO3 �������� c ����������
��������A��C�Ĺ�ϵʽ֪������0.2mol��C��ҪA�����ʵ���= [0.2/2]��4=0.4mol�� vA= 0.4/2/4=0.05mol/��L��s�� ��v��B��=0.0125mol��L-1��s-1������n��B��=0.0125��2��4=0.1 mol��
4A��g��+B��g��=2C��g��
��ʼ 0.5 0
�仯 0.4 0.1 0.2
4sĩ��0.2 0.2
����������ϵ���Կ�������ӦǰA��0.4+0.2=m0.6ol��B��ת����= 0.1/0.5��100%=20%

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
