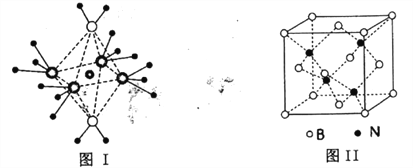
��Ŀ����
����Ŀ����1��0.1L K2SO4��MgSO4�Ļ����Һ�У���Mg2+ 2.4g��SO42�������ʵ���Ũ��Ϊ1.5mol/L����MgSO4��K2SO4�����ʵ���Ũ�ȣ�_____________
��2�������£���20.0g��������Ϊ14.0%��KNO3��Һ��30.0g��������Ϊ24.0%��KNO3��Һ��ϣ��õ����ܶ�Ϊ1.15g/cm3�Ļ����Һ�����㣺
�ٻ�Ϻ���Һ������������_________
�ڻ�Ϻ���Һ�����ʵ���Ũ�ȣ�________
����1000gˮ�����ܽ����Ħ��KNO3����ʹ��Ũ��ǡ����������Ϻ���Һ��Ũ����ȣ�_____________
���𰸡�c(MgSO4 )=1 mol/L c(K2SO4)=0.5mol/L 20�� 2.28mol/L 2.48mol
��������
��1��0.1LK2SO4��MgSO4�Ļ����Һ�У���Mg2+2.4g����þ���ӵ����ʵ���Ũ����2.4g��24g/mol��0.1mol���������þ�����ʵ�����0.1mol��MgSO4��Ũ����0.1mol��0.1L��1.0mol/L��SO42�������ʵ���Ũ��Ϊ1.5mol/L������Һ������������ʵ�����0.1L��1.5mol/L��0.15mol������������к��е��������0.15mol��0.1mol��0.05mol����K2SO4�����ʵ���Ũ��Ϊ0.05mol��0.1L��0.5mol/L��
��2���ٻ�Ϻ���Һ��KNO3��������Ϊ��20.0 g��14.0%��30.0 g��24.0%��10.0 g����Һ������Ϊ��20.0 g��30.0 g��50.0 g����˻����Һ��KNO3����������Ϊ��w��KNO3����10g/50g��100%��20%��
�ڻ�Ϻ���Һ�е�KNO3�����ʵ���Ϊ��n��KNO3����10g��101g/mol��0.099 mol����Ϻ���Һ�������Ϊ50g��1.15g/mL��43.48mL��0.04348 L�����Ի�Ϻ���Һ��KNO3�����ʵ���Ũ��Ϊ��c��KNO3����0.099mol��0.04348L��2.28 mol/L��
������Ҫ����ص����ʵ�����xmol����������Ϸ�����֪![]() �����x��2.48������1000gˮ�����ܽ�2.48Ħ��KNO3����ʹ��Ũ��ǡ����������Ϻ���Һ��Ũ����ȡ�
�����x��2.48������1000gˮ�����ܽ�2.48Ħ��KNO3����ʹ��Ũ��ǡ����������Ϻ���Һ��Ũ����ȡ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�