题目内容
9.下列说法正确的是( )| A. | 水的电离方程式:H2O=H++OH- | |
| B. | pH=7的溶液一定是中性溶液 | |
| C. | 升高温度,水的电离程度增大 | |
| D. | 将稀醋酸加水稀释时,c(H+)减小,c(OH-)也减小 |
分析 A、水为弱电解质,电离需要可逆号;
B、中性溶液中氢离子浓度等于氢氧根离子浓度;
C、水的电离为吸热反应;
D、水的离子积一定温度下为常数,据此解答即可.
解答 解:A、水为弱电解质,电离方程式为:H2O?H++OH-,故A错误;
B、溶液酸碱性只取决于溶液中氢离子浓度与氢氧根离子浓度的相对大小,氢离子浓度=氢氧根浓度,溶液一定呈中性,与pH值无必然关系,故B错误;
C、水的电离为吸热反应,升高温度,平衡右移,水的电离程度增大,故C正确;
D、水的离子积一定温度下为常数,醋酸稀释,氢离子浓度减小,氢氧根离子浓度增大,故D错误,
故选C.
点评 本题主要考查的是水的电离,涉及影响水电离平衡的因素、水的离子积等,难度不大.

练习册系列答案
相关题目
19.下列反应中不属于可逆反应的是( )
| A. | Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O | |
| B. | N2+3H2$?_{催化剂}^{高温、高压}$2NH3 | |
| C. | Cl2+H2O?HCl+HClO | |
| D. | 2NO2?N2O4 |
20.已知R2+核外有X个电子,相对原子质量为M,这种元素所含的中子数是( )
| A. | M-X-2 | B. | M-X+2 | C. | X-2 | D. | M-2 |
17.下列关于甲烷的叙述中不正确的是( )
| A. | 甲烷分子的空间结构为正四面体,4条C-H键完全相同 | |
| B. | 甲烷可使澄清石灰水变浑浊 | |
| C. | 甲烷不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲烷与氯气在光照下可以发生取代反应 |
4.下列有关物质用途的说法中,不正确的是( )
| A. | 铁红常用作红色油漆和涂料 | |
| B. | 明矾可用作净水剂 | |
| C. | 氯气可用于制造漂白粉 | |
| D. | 氧化钠常用作呼吸面具中氧气的来源 |
 互为同系物且一氯代物只有两种的物质的结构简式:
互为同系物且一氯代物只有两种的物质的结构简式: 或
或 .
.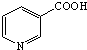 )俗称烟酸,微溶于水.可作血管扩张类药物.完成下列填空:
)俗称烟酸,微溶于水.可作血管扩张类药物.完成下列填空: .试剂浓硝酸、浓硫酸.
.试剂浓硝酸、浓硫酸.