题目内容
【题目】一、某同学欲探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铁、铜反应的实验中的有关问题。
(1)在常温下,分别向盛有等量铁片的四支试管中加入等体积的①浓硫酸②稀硫酸③浓硝酸④稀硝酸,能观察到发生明显反应的是__________(填序号,下同),无明显现象的是____________
(2)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸②稀硫酸③浓硝酸④稀硝酸,能观察到随即发生剧烈反应的是______;能缓慢发生反应的是______,反应的离子方程式为:___________________________;开始不反应,加热后发生反应的是______;加热也不发生反应的是______。
先将铜与浓硫酸反应产生的气体X持续通入如图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括______。
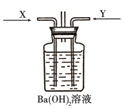
a.通入X气体后先产生白色沉淀后溶解 b.通入X气体后溶液中无明显现象
c.通入Y气体后有沉淀产生 d.通入Y气体后沉淀溶解
e.通入Y气体后溶液中无明显现象
二、从物质X出发有如下图所示的一系列变化。已知X为酸式盐,A、C为无色气体,反应的某些产物已经略去。

(1)写出下列物质的化学式:X:_______________________;G:____________________。
(2)写出反应②的化学方程式:____________________________________________。
(3)向X的溶液中加入过量的NaOH溶液,并加热,写出该反应的离子方程式:_______________。
(4)反应④中氧化剂与还原剂的质量之比为_______________。
【答案】②④ ①③ ③ ④ 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O ① ② a、c NH4HCO3 HNO3 4NH3+5O2![]() 4NO+6H2O NH4++HCO3-+2OH-
4NO+6H2O NH4++HCO3-+2OH-![]() CO32-+NH3↑+2H2O 1∶2
CO32-+NH3↑+2H2O 1∶2
【解析】
一、(1)铁为活泼金属,所以铁与稀硫酸、稀硝酸反应反应;常温下铁与浓硫酸、浓硝酸发生钝化现象;
(2)③浓硝酸常温下就能与Cu反应生成硝酸铜、二氧化氮和水;①浓硫酸常温与Cu不反应,加热条件下反应生成硫酸铜、二氧化硫和水;②稀硫酸与Cu加热也不反应;④稀硝酸氧化性比浓硝酸弱,常温下与Cu反应生成NO、硝酸铜和水,反应较缓慢;
二、X为酸式盐,A、C为无色气体,结合图中反应①②可知,C应为NH3,D为O2,E为NO,F为NO2,则B应为H2O,G为HNO3,A可与Na2O2反应生成O2,则A应为CO2,X可能为NH4HCO3,结合相关物质的性质解答该题。
一、(1)铁为活泼金属,所以铁与稀硫酸、稀硝酸反应反应;常温下铁与浓硫酸、浓硝酸发生钝化现象,阻止了反应继续进行,所以观察到明显现象的为②④;没有明显现象的为①③,
故答案为:②④;①③;
(2)③浓硝酸常温下就能与Cu反应生成硝酸铜、二氧化氮和水;①浓硫酸常温与Cu不反应,加热条件下反应生成硫酸铜、二氧化硫和水;②稀硫酸与Cu加热也不反应;④稀硝酸氧化性比浓硝酸弱,常温下与Cu反应生成NO、硝酸铜和水,反应较缓慢,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
铜与浓硫酸反应产生的气体X为二氧化硫,二氧化硫与氢氧化钡反应生成白色沉淀亚硫酸钡;铜与浓硝酸反应产生的大量气体Y为二氧化氮,二氧化氮溶于水生成硝酸,硝酸能把亚硫酸钡氧化成硫酸钡,所以正确的为ac,
故答案为:③;①;②;④;ac;
二、X为酸式盐,A、C为无色气体,结合图中反应①②可知,C应为NH3,D为O2,E为NO,F为NO2,则B应为H2O,G为HNO3,A可与Na2O2反应生成O2,则A应为CO2,X可能为NH4HCO3,
(1)由以上分析可知X可能为NH4HCO3,G为HNO3;
(2)反应②的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)向X的溶液中加入过量的NaOH溶液,并加热,该反应的离子方程式为NH4++HCO3-+2OH-![]() CO32-+NH3↑+2H2O;
CO32-+NH3↑+2H2O;
(4)反应④为3NO2+H2O=2HNO3+NO,NO2既是氧化剂又是还原剂,由N原子守恒可知,氧化剂与还原剂的质量比为1:2。

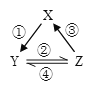
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | NaOH | Na2CO3 | NaHCO3 | ②通入适量CO2 | |
C. | Cu | CuSO4 | Cu(OH)2 | ③加热 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D