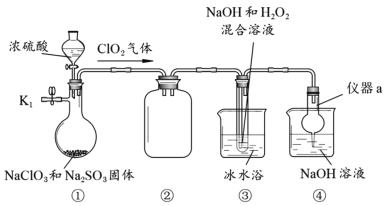
题目内容
【题目】Ⅰ.把5.1g镁铝合金的粉末放入足量的氢氧化钠溶液中,得到2.24LH2(标准状况下测定)。
(1)合金中镁的质量为________。
(2)写出该合金溶于足量的氢氧化钠溶液的化学方程式:_________________________。
Ⅱ. 在AlCl3和MgCl2的混合溶液中逐滴加入氢氧化钠溶液,生成沉淀的物质的量与加入氢氧化钠的物质的量的关系如图所示。
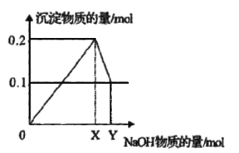
(3)在混合溶液中AlCl3和MgCl2的物质的量之比为_____________。
(4)写出XY段发生反应的离子方程式_____________________________。
(5)X=____________;Y=____________。
【答案】3.3g 2Al+2NaOH+2H2O=2Na AlO2+3H2↑ 1:1 Al(OH)3+ OH-=AlO2-+H2O 0.5 0.6
【解析】
把5.1g镁铝合金的粉末放入足量的氢氧化钠溶液中,只有![]() 和
和![]() 反应,反应方程式为:
反应,反应方程式为: ![]()
在![]() 和
和![]() 的混合溶液中逐滴加入氢氧化钠溶液,发生反应
的混合溶液中逐滴加入氢氧化钠溶液,发生反应![]() ,
,![]() 沉淀溶解时发生的反应方程式为:
沉淀溶解时发生的反应方程式为:![]() ,沉淀减少的量是
,沉淀减少的量是![]() 溶解部分,为
溶解部分,为![]() ,据此解答。
,据此解答。
⑴据分析,![]() 和
和![]() 的化学反应方程式为:
的化学反应方程式为: ![]() ,
,![]() ,
, ![]() ,
, ![]() ,故答案为:3.3g;
,故答案为:3.3g;
⑵![]() 和
和![]() 的化学反应方程式为
的化学反应方程式为![]() ,故答案为:
,故答案为:![]() ;
;
⑶沉淀减少是因为![]() 溶解,物质的量为
溶解,物质的量为![]() ,据分析得
,据分析得![]() ,
,![]() ,
,![]() 故答案为
故答案为
⑷XY段是![]() 溶解的反应
溶解的反应![]() ,写为离子方程式
,写为离子方程式![]() 故答案为:
故答案为:![]() ;
;
⑸![]() ,
,![]()
![]() ,
,![]()
![]() 得
得![]() ,
,![]() ,故答案为:0.5mol,0.6mol。
,故答案为:0.5mol,0.6mol。

【题目】Ⅰ、重金属离子对河流及海洋造成严重污染。某化工厂废水(pH=2.0,ρ≈1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入_____(填字母序号),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
(2)常温下,如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=___。
(3)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%。若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag+)=__,是否符合排放标准__(填“是”或“否”)。已知Ksp(AgCl)=1.8×10-10mol2·L-2。
Ⅱ、为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2mL0.005 mol/LAgNO3溶液中加入2 mL0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)=8.3×1017 ,Ksp(AgSCN,白色)= 1.0×1012 。
回答下列问题:
(4)步骤3中现象a是_______。
(5)向50mL0.005 mol/L的AgNO3溶液中加入150mL0.005 mol/L的KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为____
【题目】现有氮及其化合物的转化关系如下图,则下列说法错误的是
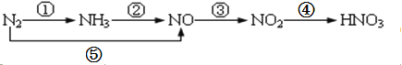
A.路线①②⑤均能表示氮的固定
B.路线②③④是工业生产硝酸的主要途径
C.路线⑤③④是“雷雨发庄稼”的主要途径
D.上述所有反应都是氧化还原反应
【题目】下图所示的装置中,烧瓶中充满干燥气体a,然后打开弹簧夹f,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,烧瓶中的液体d呈喷泉喷出,最终几乎充满烧瓶。下列各组不可能出现上述现象的是
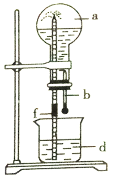
序号 | a(干燥气体) | b(液体)与d(液体) |
A | NO | 水 |
B | CO2 | 4mol·L-1NaOH溶液 |
C | Cl2 | 4mol·L-1NaOH溶液 |
D | NH3 | 1mol·L-1盐酸 |
A.AB.BC.CD.D