题目内容
K、Ki、KW分别表示化学平衡常数、电离常数和水的离子积,下列判断正确的是( )
| A.在500 ℃、20 MPa、5 L的密闭容器中进行合成氨的反应,使用催化剂后K值增大 |
| B.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大 |
| C.25 ℃时,pH 均为4的盐酸和NH4I(aq)中KW不相等 |
D.2SO2+O2 2SO3达平衡后,改变某一条件K值不变,SO2的转化率可能增大、减小或不变 2SO3达平衡后,改变某一条件K值不变,SO2的转化率可能增大、减小或不变 |
D
解析

练习册系列答案
相关题目
利用反应:2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH ="+746.8" kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是 ( )
2CO2(g)+N2(g) ΔH ="+746.8" kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是 ( )
| A.降低温度 |
| B.增大压强同时加催化剂 |
| C.升高温度同时充入N2 |
| D.及时将CO2和N2从反应体系中移走 |
在某恒容的密闭容器中,可逆反应A(g)+B(g) xC(g)有如图所示的关系曲线,下列说法正确的是( )
xC(g)有如图所示的关系曲线,下列说法正确的是( )
| A.温度:T1>T2 | B.压强:p1>p2 |
| C.正反应是吸热反应 | D.x的值是2 |
为了变废为宝,控制温室效应,工业上可用CO2来生产甲醇。一定条件下发生如下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是 ( )。
CH3OH(g)+H2O(g)。如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,下列措施中不能使c(CH3OH)增大的是 ( )。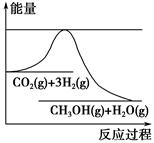
| A.降低温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出来 |
| D.再充入1 mol CO2和3 mol H2 |
在容积为2 L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g),其他条件不变,在300 ℃和500 ℃时,甲醇物质的量n(CH3OH)反应时间t的变化曲线如图所示,下列说法正确的是( )
CH3OH(g),其他条件不变,在300 ℃和500 ℃时,甲醇物质的量n(CH3OH)反应时间t的变化曲线如图所示,下列说法正确的是( )
| A.该反应的ΔH>0 |
B.其他条件不变,升高温度反应的平衡常数增大 |
C.300 ℃时,0~t1 min内 CH3OH的平均生成速率为 mol·L-1·min-1 mol·L-1·min-1 |
D.A点的反应体系从300 ℃升高到500 ℃,达到平衡时 减小 减小 |
下列实验事实不能用平衡移动原理解释的是( )。
A. |
B. |
C. |
D. |
碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq) I3—(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
I3—(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
| A.上述正反应为放热反应 |
| B.上述体系中加入苯,平衡不移动 |
| C.可运用该反应原理除去硫粉中少量的碘单质 |
| D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液 |
向一容积为1 L的密闭容器中加入一定量的X、Y,发生反应aX(g)+2Y(s) bZ(g) ΔH<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) ΔH<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。
根据以上信息,下列说法正确的是 ( )。
| A.用X表示0~10 min内该反应的平均速率为v(X)=0.045 mol·L-1·min-1 |
| B.根据上图可求得化学方程式中a∶b=1∶3 |
| C.推测在第7 min时曲线变化的原因可能是升温 |
| D.推测在第13 min时曲线变化的原因可能是降温 |

