题目内容
5.在密闭容器中进行X2(g)+3Y2(g)?2Z(g)的反应,其中X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,当反应达到平衡时,各物质的浓度可能的是( )| A. | Z=0.5 mol/L | B. | Z=0.4 mol/L | ||
| C. | Y2=0.5 mol/L或X2=0.1 mol/L | D. | X2=0.2 mol/L或Y2=0.6 mol/L |
分析 化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:若反应向正反应进行,假定完全反应,则:
X2(g)+3Y2(g)?2Z(g)
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0 0 0.4
若反应逆反应进行,假定完全反应,则:
X2(g)+3Y2(g)?2Z(g)
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.3 0.2
平衡(mol/L):0.2 0.6 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2,0<c(Y2)<0.6,0<c(Z)<0.4,故C正确、ABD错误;
故选:C.
点评 本题考查化学平衡的建立,关键是利用可逆反应的不完全性,运用极限假设法解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.Ⅰ.碱性锌锰干电池是最常见的化学电源之一,已知其电池总反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极发生反应的物质为Zn+2OHˉ-2eˉ=Zn(OH)2;发生在正极的电极反应为MnO2+H2O+e-=MnO(OH)+OH-.
Ⅱ.回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、MnOOH、Fe和炭黑等),由锰粉制取MnO2的步骤如图所示:
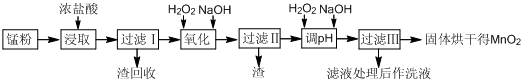
根据如图所示步骤并参考表格数据回答问题:
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.加热的作用是加快反应速率.
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入适量H2O2溶液,其作用是将Fe2+转化为Fe3+.
(3)将过滤I所得滤液经H2O2氧化后,再加入NaOH溶液调节pH的范围是:3.7<pH<8.3,其目的是使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀.
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O.
(5)实验室进行过滤操作时,需要用到的玻璃仪器有漏斗、烧杯、玻璃棒.
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极发生反应的物质为Zn+2OHˉ-2eˉ=Zn(OH)2;发生在正极的电极反应为MnO2+H2O+e-=MnO(OH)+OH-.
Ⅱ.回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、MnOOH、Fe和炭黑等),由锰粉制取MnO2的步骤如图所示:

| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.加热的作用是加快反应速率.
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入适量H2O2溶液,其作用是将Fe2+转化为Fe3+.
(3)将过滤I所得滤液经H2O2氧化后,再加入NaOH溶液调节pH的范围是:3.7<pH<8.3,其目的是使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀.
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O.
(5)实验室进行过滤操作时,需要用到的玻璃仪器有漏斗、烧杯、玻璃棒.
16.标准状况下质量为4g H2的体积约为( )
| A. | 11.2 L | B. | 22.4 L | C. | 33.6 L | D. | 44.8 L |
13.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 钠与水的反应:2Na+2H2O═2Na++OH-+H2↑ | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
20.有机化合物M的结构简式如图所示,有关化合物M的叙述正确的是( )
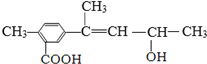
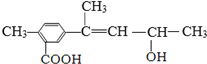
| A. | M的分子式为C13H18O3 | |
| B. | M一定条件下,可以发生加成、酯化、水解等反应 | |
| C. | 1mol M与足量金属钠反应,可生成标准状况下的H211.2 L | |
| D. | 1mol M最多能与4mol H2发生加成反应 |
17.在容积一定的密闭窗口中,反应A?B(g)+C(s)达平衡,若继续升高温度,容器内气体的密度增大,下列判断正确的是( )
| A. | 压强对该反应的平衡移动没有影响 | |
| B. | 在平衡体系中加入C,混合气体平均分子量增大 | |
| C. | 若正反应为吸热反应,则A为非气态 | |
| D. | 若正反应为放热反应,则A为非气态 |
14.下列说法不正确的是( )
| A. | 分散质粒子的直径在10-9~10-7m之间的分散系叫做胶体 | |
| B. | KAl(SO4)2在水溶液中电离方程式为KAl(SO4)2═K++Al3++2SO42- | |
| C. | 利用丁达尔效应可以鉴别CuSO4溶液和氢氧化铁胶体 | |
| D. | 在FeCl3溶液中滴加NaOH溶液可得氢氧化铁胶体 |
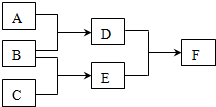 现有A、B、C、D、E、F六种中学化学中常见的物质,其中A、B、C是由短周期元素组成的单质,一定条件下转化关系如下(反应条件已略去):
现有A、B、C、D、E、F六种中学化学中常见的物质,其中A、B、C是由短周期元素组成的单质,一定条件下转化关系如下(反应条件已略去):