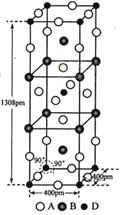
题目内容
【题目】如下表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(1)③④⑦的原子半径由大到小的顺序为____(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为____(用酸的化学式表示)。
(3)②④两种元素按原子个数之比为1:1组成的化合物的电子式____。
(4)①②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式___。
(5)表中⑤的单质和④的最高价氧化物水化物反应的化学方程式为____。
【答案】Na>Cl>F HClO4>H2SO4 ![]() 2H++2Fe2++H2O2=2Fe3++2H2O Si+2NaOH+H2O=Na2SiO3+2H2↑
2H++2Fe2++H2O2=2Fe3++2H2O Si+2NaOH+H2O=Na2SiO3+2H2↑
【解析】
根据元素在周期表中的位置可知①是H元素;②是O元素,③是F元素,④是Na元素,⑤是Si元素,⑥是S元素,⑦是Cl元素,以此解答。
(1)同一周期的元素原子序数越大,原子半径越小;同一主族的元素原子核外电子层数越多,原子半径就越大;
(2)元素的非金属性越强,其最高价含氧酸的酸性越强;
(3)②④两种元素按原子个数之比为1:1组成的化合物为Na2O2,Na2O2是钠离子和过氧根离子构成的离子化合物;
(4)①是H元素;②是O元素,两种元素按原子个数之比为1:1组成的常见液态化合物是H2O2,根据电子守恒、原子守恒和电荷守恒可得该反应的离子方程式;
(5)⑤是Si元素,④是Na元素最高价氧化物水化物是NaOH。
(1)根据元素在周期表中的位置可知③是F元素,④是Na元素,⑦是Cl元素。同一周期的元素原子序数越大,原子半径越小;同一主族的元素原子核外电子层数越多,原子半径就越大,因此这三种元素的原子半径由大到小的顺序为Na>Cl>F;
(2)根据元素在周期表中的位置可知⑥是S元素,⑦号元素是Cl,元素的非金属性越强,其最高价含氧酸的酸性越强。元素的非金属性Cl>S,所以最高价含氧酸的酸性越强强弱为HClO4>H2SO4;
(3)②④两种元素按原子个数之比为1:1组成的化合物为Na2O2,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为![]() ;
;
(4)①是H元素;②是O元素,两种元素按原子个数之比为1:1组成的常见液态化合物是H2O2,有强的氧化性,在酸性溶液中能将Fe2+氧化,根据电子守恒、原子守恒和电荷守恒可得该反应的离子方程式是H2O2+2Fe2++2H+=2Fe3++2H2O;
(5)⑤是Si元素,④是Na元素最高价氧化物水化物是NaOH,Si和氢氧化钠反应生成硅酸钠、水和氢气,方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑。

【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):

已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有______________ (写出一点即可)。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是______________,该步骤中加入H2O2发生反应的离子方程式为_______________________________________。
(3)步骤D的操作名称为________________________________________________。
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全
部转化为Na2[Zn(OH)4]溶液,该反应的化学方程式为_________________________;然后将FeO、CuO过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为_____________________________________________。