题目内容
已知同温下,Ksp(AgCl)>Ksp(AgBr).现将AgCl与 AgBr的饱和溶液等体积混合,再加入足量的浓硝酸银溶液,发生的反应为( )
分析:向AgCl与 AgBr的饱和溶液中,加入AgNO3,AgCl与AgBr的溶解平衡向左移动,但AgBr的溶解度更小,溶液中AgCl沉淀较多.
解答:解:在AgCl和AgBr两饱和溶液中,前者c(Ag+)大于后者c(Ag+),c(Cl-)>c(Br-),当将AgCl、AgBr两饱和溶液混合时,发生沉淀的转化,生成更多的AgBr沉淀,与此同时,溶液中n(Cl-)比原来AgCl饱和溶液中大,当加入足量的浓AgNO3溶液时,AgBr沉淀有所增多,但AgCl沉淀增加更多.
故选D.
故选D.
点评:本题考查难溶电解质的溶解平衡,题目难度中等,解答本题时注意AgCl的溶解度比AgBr大,加入硝酸银,抑制溶解平衡向右移动,生成沉淀更多.

练习册系列答案
相关题目
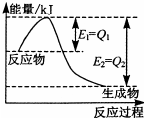 运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.