题目内容
下列说法中,不正确的是( )
分析:A、化学反应伴化学键的断裂和形成,必然有能量的变化;
B、吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量;
C、化学反应中的能量变化主要是由化学键的断裂和形成引起的;
D、化学反应中生成物总能量不等于反应物的总能量,反应前后的能量差值为化学反应中的能量变化;
B、吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量;
C、化学反应中的能量变化主要是由化学键的断裂和形成引起的;
D、化学反应中生成物总能量不等于反应物的总能量,反应前后的能量差值为化学反应中的能量变化;
解答:解:A、化学反应伴化学键的断裂和形成,必然有能量的变化,通常表现为热量的变化,故A正确;
B、放热反应有的需加热,有的不需加热,如木炭的燃烧是放热反应,但需要点燃,点燃的目的是使其达到着火点,故B错误;
C、由化学键的断裂吸收能量,化学键的形成放出能量,由于吸收的能量和放出的能量不等,化学反应产生了能量变化,故C正确;
D、放热反应:反应物所具有的总能量高于生成的总能量,放热反应:反应物所具有的总能量低于生成的总能量,故D正确;
故选:B.
B、放热反应有的需加热,有的不需加热,如木炭的燃烧是放热反应,但需要点燃,点燃的目的是使其达到着火点,故B错误;
C、由化学键的断裂吸收能量,化学键的形成放出能量,由于吸收的能量和放出的能量不等,化学反应产生了能量变化,故C正确;
D、放热反应:反应物所具有的总能量高于生成的总能量,放热反应:反应物所具有的总能量低于生成的总能量,故D正确;
故选:B.
点评:该题考查了化学反应的条件与化学反应的热效应间的关系.需正确理解放热吸热的本质,是解题的关键.

练习册系列答案
相关题目
 C60的发现导致了一门新兴学科--碳球化学的兴起.根据对其分子结构特点的研究,科学家预测,C60的很多化合物可能在超导体、长效药物载体等方面有着重要的应用.目前已证明,C60与金属钾作用得到一种物质K3C60,其在低温下具有超导性能.下列说法中,不正确的是( )
C60的发现导致了一门新兴学科--碳球化学的兴起.根据对其分子结构特点的研究,科学家预测,C60的很多化合物可能在超导体、长效药物载体等方面有着重要的应用.目前已证明,C60与金属钾作用得到一种物质K3C60,其在低温下具有超导性能.下列说法中,不正确的是( )| A、C60是一种含碳化合物 | B、在C60和 K3C60中,碳元素分别以游离态和化合态存在 | C、K3C60是一种新型的化合物 | D、C60是碳元素的一种单质 |
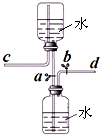 如图是某同学设计的储气装置(固定装置已略去),下列说法中,不正确的是( )
如图是某同学设计的储气装置(固定装置已略去),下列说法中,不正确的是( )