题目内容
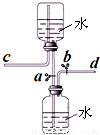
 如图是某同学设计的储气装置(固定装置已略去),下列说法中,不正确的是( )
如图是某同学设计的储气装置(固定装置已略去),下列说法中,不正确的是( )分析:根据该装置的工作原理来分析,在通入气体或排出气体时都要通过控制止水夹a、b来完成操作.如果气体从d进入,打开止水夹ab,在大气压力的作用下,气体可储存在下面的瓶子里;当打开止水夹a、b,靠水的重力即可方便地将气体排出;此装置还可用于固液不加热反应制取气体.
解答:解:A、打开止水夹a、b,气体从d管导入,储存在下面的瓶子里,气体压强导致导致水被压入上瓶,这是利用排水集气法来收集气体,故A正确;
B、取用气体时,由于c是与外界相通,打开止水夹a、b,靠水的重力即可方便地将气体排出,故B正确;
C、由于此装置工作原理是通过重力作用来完成的,所以c必须是与外界相通,则不需要安装止水夹,故C错误;
D、下边瓶中放入石灰石,上边的瓶中放入稀盐酸即能完成实验室制取二氧化碳的发生装置,故D正确.
故选C.
B、取用气体时,由于c是与外界相通,打开止水夹a、b,靠水的重力即可方便地将气体排出,故B正确;
C、由于此装置工作原理是通过重力作用来完成的,所以c必须是与外界相通,则不需要安装止水夹,故C错误;
D、下边瓶中放入石灰石,上边的瓶中放入稀盐酸即能完成实验室制取二氧化碳的发生装置,故D正确.
故选C.
点评:本题主要考查根据课本所学知识分析新实验装置的能力,培养同学们的分析问题、解决问题的能力,难度中等.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
( 12分)过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用。
12分)过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用。
已知:过碳酸钠与硫酸溶液反应的化学方程式如下: Na2CO4 +H2SO4 →Na2SO4 +H2O2 + CO2↑  2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。
2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。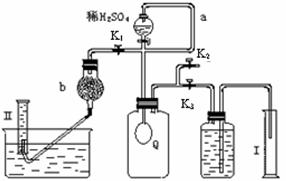
⑴Q内发生反应生成的气体为__________,导管a作用是 。
⑵为测出反应时生成气体的总体积,滴稀H2SO4前必须关闭K1、K2,打开K3。当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1,这时可观察到的现象是_________ _____,b中装的碱石灰的作用是_ ____________
____________ _____。
_____。
⑶实验结束时,量筒I中有xmL水,量筒Ⅱ中收集到ymL气体(上述体积均已折算到标准状况),则过碳酸钠的纯度是____________
⑷某同学实验测得的过碳酸钠的纯度超过100%,你认为可能的原因是_______
| A.气体滞留在Q和导气管中,未全部进入量筒Ⅱ |
B.量筒Ⅱ读数时 ,量筒液面高于水槽液面 ,量筒液面高于水槽液面 |
| C.右侧量筒Ⅰ和储液集气瓶连接导管内的液体没有计入读数x |
| D.气体体积数值x、y没有扣除滴加的硫酸的体积 |
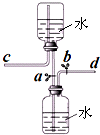 如图是某同学设计的储气装置(固定装置已略去),下列说法中,不正确的是
如图是某同学设计的储气装置(固定装置已略去),下列说法中,不正确的是