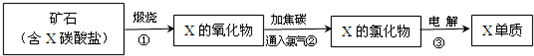
题目内容
(14)已知元素X、Y、Z、W的原子序数分别为6、8、11、13,请回答:
(1)写出下列元素符号X Y Z W
(2)写出下列元素在周期表中的位置X Y
Z W
(3)写出下列反应方程式:X+Y
Z+Y W+Y
(共14分每空1分,方程式2分)
(1)X:碳元素 Y:氧元素 Z:钠元素 W:铝元素
(2)第二周期第ⅣA、第二周期第ⅥA、第三周期第IA、第三周期第ⅢA
(3)C+O2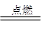 CO2; 4Na+O2=2Na2O或者2Na+O2
CO2; 4Na+O2=2Na2O或者2Na+O2 Na2O2;
Na2O2;
4Al+3O2 2Al2O3
2Al2O3
解析

练习册系列答案
相关题目