��Ŀ����
����Ŀ����������ҺW�ĵ����������ϵ�з�Ӧ��ͼ�е�ÿһ�����ʾ�йص�һ����Ҫ��Ӧ����������Ӧ�м�������ɵ�ˮ�Լ����ɵ�������������ȥ��������A��B��C��D��E�ڳ����¾�Ϊ��̬���ʣ�X��K����ѧ�����Ľ������ʣ�������Y��һ�ֱȽϺõ��ͻ���ϣ�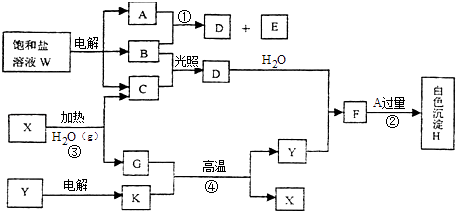
�ش��������⣺
��1��X��Y�Ļ�ѧʽ�ǣ�X �� Y ��
��2��A�ĵ���ʽ�� �� B�ľ��������� ��
��3����Ӧ�ڵ����ӷ���ʽ�� ��
��4����������ҺW���Ļ�ѧ����ʽ�� ��
��5����֪C��ȼ����Ϊ285.8kJ/mol����д��C���û�ѧʽ��ʾ��ȼ������Һ̬���ʵ��Ȼ�ѧ����ʽ ��
���𰸡�
��1��Fe��Al2O3
��2��![]() �����Ӿ���
�����Ӿ���
��3��Al3++3NH3?H2O=Al��OH��3��+3NH4+
��4��2NH4Cl ![]() Cl2��+H2��+2NH3��
Cl2��+H2��+2NH3��
��5��2H2��g��+O2��g��=2H2O��l������H=��571.6kJ/mol
���������⣺A��B��C��D��E�ڳ����¾�Ϊ��̬���ʣ�X��K����ѧ�����Ľ������ʣ�K�ڸ�����������X����÷�ӦΪ���ȷ�Ӧ��KΪ����XΪ����������Y��һ�ֱȽϺõ��ͻ���ϣ�Y�������������YΪ��������X��ˮ��������GΪ������������CΪ��������������ҺW�ĵ������������壬��B��C�ڹ�������������D����BΪCl2 �� ����DΪHCl��A��B��Ӧ����D��E����AΪNH3 �� EΪN2 �� ����WΪNH4Cl��D��Y��Ӧ����FΪAlCl3 �� F������İ�ˮ��Ӧ���ɰ�ɫ����HΪAl��OH��3 �� ��1����������ķ�����֪��XΪ����YΪ��������X��Y�Ļ�ѧʽ�ֱ�ΪFe��Al2O3 �� ���Դ��ǣ�Fe��Al2O3����2��AΪNH3 �� A�ĵ���ʽ�� ![]() ��BΪCl2 �� B�ľ��������Ƿ��Ӿ��壬���Դ��ǣ�
��BΪCl2 �� B�ľ��������Ƿ��Ӿ��壬���Դ��ǣ� ![]() �����Ӿ��壻��3����Ӧ�ڵ����ӷ���ʽ��Al3++3NH3H2O=Al��OH��3��+3NH4+ �� ���Դ��ǣ�Al3++3NH3H2O=Al��OH��3��+3NH4+����4��WΪNH4Cl����������ҺW���Ļ�ѧ����ʽ��2NH4Cl
�����Ӿ��壻��3����Ӧ�ڵ����ӷ���ʽ��Al3++3NH3H2O=Al��OH��3��+3NH4+ �� ���Դ��ǣ�Al3++3NH3H2O=Al��OH��3��+3NH4+����4��WΪNH4Cl����������ҺW���Ļ�ѧ����ʽ��2NH4Cl ![]() Cl2��+H2��+2NH3�������Դ��ǣ�2NH4Cl
Cl2��+H2��+2NH3�������Դ��ǣ�2NH4Cl ![]() Cl2��+H2��+2NH3������5��CΪ��������֪C��ȼ����Ϊ285.8kJ/mol������Cȼ������Һ̬���ʵ��Ȼ�ѧ����ʽΪ2H2��g��+O2��g��=2H2O��l������H=��571.6kJ/mol�����Դ��ǣ�2H2��g��+O2��g��=2H2O��l������H=��571.6kJ/mol��
Cl2��+H2��+2NH3������5��CΪ��������֪C��ȼ����Ϊ285.8kJ/mol������Cȼ������Һ̬���ʵ��Ȼ�ѧ����ʽΪ2H2��g��+O2��g��=2H2O��l������H=��571.6kJ/mol�����Դ��ǣ�2H2��g��+O2��g��=2H2O��l������H=��571.6kJ/mol��

 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
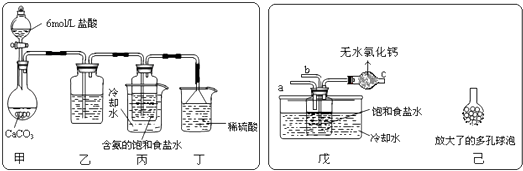
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�����Ŀ��ijʵ��С�������50mL1.0mol/L�����50mL1.1mol/L����������Һ����ͼװ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��ش��������⣺ 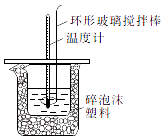
��1�������������������� ��
��2���кͷ�Ӧ�ų���������������������ڷ�Ӧ�лӷ������õ��к��ȵ���ֵ���ƫ����ƫС�����䡱����
��3����ʵ��С����������ʵ�飬ÿ��ȡ��Һ��50mL������ʵ�����ݼ�¼�����
ʵ����� | �� ��ʼ�¶�t1/�� | ��ֹ�¶ȣ�t2���� | �²t2��t1���� | ||
���� | ��NaOH��Һ | ƽ��ֵ | |||
1 | 25.1 | 24.9 | 25.0 | 31.8 | 6.8 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
��֪���ᡢNaOH��Һ���ܶ���ˮ��ͬ���кͺ����ɵ���Һ�ı�����c=4.18��10��3kJ/��g�棩����÷�Ӧ���к��ȡ�H= ��
��4�����к��Ȳⶨʵ���У�������ʼ�¶�ʱ��Ҫ�����¶ȼƣ����ֻ��һ���¶ȼƲ��������õ��к��ȵ���ֵ���ƫ����ƫС�����䡱����