题目内容
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeSO4,其流程如下:
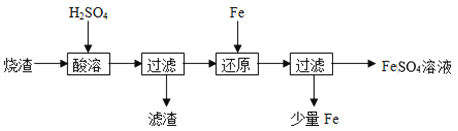
(1)“酸溶”时,提高反应速率的措施有__________(写一条)。
(2)加入Fe粉还原后,检验Fe3+是否反应完全的试剂为_____。
(3)写出“还原”步骤中,Fe粉和Fe3+反应的离子方程式:_________。
【答案】适当加热升温等 KSCN溶液 2Fe3+ + Fe = 3Fe2+
【解析】
烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用铁还原Fe3+后过滤,得滤液中含有硫酸亚铁,据此分析解答。
(1)要提高反应速率,可以通过加热、增加硫酸的浓度、固体粉碎及搅拌等措施,故答案为:加热(或增加硫酸的浓度或将烧渣粉碎或搅拌);
(2)Fe3+与KSCN溶液反应呈血红色,检验Fe3+是否反应完全可选择KSCN溶液,具体方法是取少量溶液,滴入几滴KSCN溶液,若溶液变为血红色,说明其中含有Fe3+,反应未完全,若溶液无明显现象,说明反应完全,故答案为:KSCN溶液;
(3)“还原”步骤中,Fe粉和Fe3+反应的离子方程式为2Fe3+ + Fe = 3Fe2+,故答案为:2Fe3+ + Fe = 3Fe2+。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】近年来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
![]() 活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入
活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入![]() NO和
NO和![]() 固体活性炭
固体活性炭![]() 无杂质
无杂质![]() ,生成气体E和气体
,生成气体E和气体![]() 当温度分别在
当温度分别在![]() 和
和![]() 时,测得平衡时各物质的物质的量如下表:
时,测得平衡时各物质的物质的量如下表:
| 活性炭 | NO | E | F |
|
|
|
|
|
|
|
|
|
|
![]() 结合上表数据,写出NO与活性炭反应的化学方程式 ______ ;
结合上表数据,写出NO与活性炭反应的化学方程式 ______ ;
![]() 上述反应的平衡常数表达式
上述反应的平衡常数表达式![]() ______ ,根据上述信息判断,
______ ,根据上述信息判断,![]() 和
和![]() 的关系是 ______ ;
的关系是 ______ ;
A.![]() B.
B.![]() C.无法比较
C.无法比较
![]() 在
在![]() 下反应达到平衡后,下列措施能改变NO的转化率的是 ______ ;
下反应达到平衡后,下列措施能改变NO的转化率的是 ______ ;
![]() 增大
增大![]()
![]() 增大压强
增大压强![]() 升高温度
升高温度![]() 移去部分F
移去部分F
![]() 碘循环工艺不仅能吸收
碘循环工艺不仅能吸收![]() 降低环境污染,同时又能制得
降低环境污染,同时又能制得![]() ,具体流程如图所示
,具体流程如图所示

![]() 用离子方程式表示反应器中发生的反应 ______ ;
用离子方程式表示反应器中发生的反应 ______ ;
![]() 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出
用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出![]() 的目的是 ______ ;
的目的是 ______ ;
![]() 开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池
开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池![]() 简称
简称![]() 由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图所示
由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图所示

通过a气体的电极是原电池的 ______ 极![]() 填“正”或“负”
填“正”或“负”![]() ,b电极反应式为 ______ .
,b电极反应式为 ______ .




