题目内容
根据元素周期律和物质结构的有关知识,以下有关排序错误的是
| A.离子半径:S2->Cl->Ca2+ | B.原子半径:Ca>S>Cl |
| C.热稳定性:HCl>H2S>H2Se | D.酸性:HClO4<HBrO4<HIO4 |
D
解析试题分析:A.对于电子层结构相同的离子来说,核电荷数越大,离子半径就越小,所以离子半径:S2->Cl->Ca2+,正确;B.对于电子层数相同的元素来说,原子序数越大,原子半径就越小,对于电子层数不同的元素来说,原子核外电子层数越多,原子半径就越大,所以原子半径:Ca>S>Cl,正确;C.元素的非金属性越强,元素形成的氢化物的稳定性就越强,由于元素的非金属性:Cl>S>Se,所以热稳定性:HCl>H2S>H2Se,正确;D.元素的非金属性越强,其最高价的含氧酸的酸性就越强。元素的非金属性:Cl>Br>I,所以酸性:HClO4>HBrO4>HIO4,错误。
考点:考查元素周期表、元素周期律的应用的知识。

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
下列结论正确的是 ( )
①粒子半径:K>Cl>S ②氢化物稳定性:HF>H2S>PH3;
③离子还原性:S2->Cl->Br->I- ④单质氧化性:Cl2>S>Si;
⑤酸性:H2SO4>HClO ⑥碱性强弱:KOH>NaOH>Mg(OH)2
| A.①④⑤ | B.③⑥ | C.②④⑤⑥ | D.①③④ |
在元素周期表中,同主族元素的原子具有相同的 ( )
| A.最外层电子数 | B.核电荷数 | C.电子层数 | D.核外电子数 |
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( ) 
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:W > R |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
元素周期表中电负性最大的元素是
| A.Fr | B.F | C.H | D.N |
下列排列顺序正确的是
| A.熔点:MgBr2> Cs > Na |
| B.微粒半径:Ca2+ > C1- > Mg2+ |
| C.碱性:KOH > Mg(OH)2 > Al(OH)3 |
| D.氧化性:Cu2+ > Fe3+ > K+ |
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是( )
| A.它是副族元素 | B.它是第六周期元素 |
| C.它的原子核内有63个质子 | D.它的一种同位素的核内有89个中子 |
下列各组顺序的排列不正确的是( )
| A.原子半径:Na > Mg > Al > H | B.热稳定性: HCl < H2S < PH3 |
| C.酸性强弱:H2SiO3< H2CO3< H3PO4 | D.氧化性:K+ < Na+ < Mg2+ < Al3+ |
已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是
A.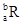 | B.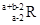 | C.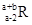 | D.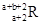 |