题目内容
【题目】食醋的总酸量即一定体积的食醋原液所含醋酸的质量,单位是g· L-1或个g/100mL。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)用酸碱滴定法测定某食醋样品中的总酸量时,下列说法中正确的是 。
A.用NaOH溶液滴定时反应的离子方程式为H++OH-=H2O
B.食醋样品不需要预先稀释一定倍数后可以直接进行滴定
C.用NaOH溶液滴定时,可使用酚酞或甲基橙作指示剂
D.若测得样品的物质的量浓度为0.75mol·L-1,则其总酸量为45g·L-1
(2)某同学仔细观察该食醋样品的标签,发现其中还含有作为食品添加剂的苯甲酸钠(C6H5COONa),他想用理论验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下醋酸与苯甲酸的 。
A.pH B.电离度 C.电离常数 D.溶解度
(3)常温下,用0.1000mol· L-1 NaOH溶液分别滴定20.00mL 0.1000mol· L-1 HCl溶液和20.00mL 0.1000mol· L-1 CH3COOH溶液,得到两条滴定曲线,如图所示。
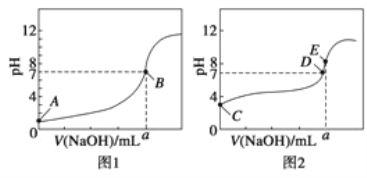
①滴定醋酸溶液的曲线是 (填“图1”或“图2”);滴定曲线中a= mL;
②E点pH>8的原因是(用离子方程式表示): 。
(4)测定食醋的总酸量实验中,配制NaOH溶液和稀释食醋所用的蒸馏水必须煮沸,目的是 。
(5)实验时,吸取食醋样品10mL于100mL容量瓶中定容。移取定容后的溶液20mL于锥形瓶中,加入1~2滴指示剂,用浓度为c mol·L-1的NaOH标准溶液滴定,平行测定三次,消耗NaOH溶液的平均体积为V mL。则原食醋样品的总酸量=____________g/100mL。
【答案】(1)D (2)C
(3)图2 20 CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
(4)除去溶解在水中的二氧化碳 (5)3cV
【解析】
试题分析:(1)A.醋酸为弱电解质,离子方程式应为CH3COOH+OH-=CH3COO-+H2O,A错误;B.食醋试样需稀释一定倍数后再进行滴定,目的为减小实验误差,B错误;C.醋酸为弱电解质,滴定终点时,溶液呈碱性,不能用甲基橙为酸碱指示剂,否则误差较大,C错误;D.食醋的物质的量浓度为0.75molL-1,总酸量为0.75molL-1×60g/mol=45g/L,D正确;答案选D;
(2)电离常数决定酸电离难易程度,由电离常数判断酸的强弱,进而判断反应能否发生,其他选项不能判断酸的强弱,答案选C;
(3)①醋酸为弱电解质,醋酸为弱酸,氯化氢为强电解质,0.1mol/L的盐酸溶液的pH=1,而0.1mol/L的醋酸溶液的pH一定大于1,根据图象中氢氧化钠溶液体积为0时溶液的pH可知,滴定醋酸溶液的曲线是图2;根据图1中氯化氢与氢氧化钠等物质的量时,溶液为中性,则a点时盐酸的体积为20.00mL;
②醋酸钠为强碱弱酸盐,醋酸根离子水解,溶液呈碱性,水解的离子方程式为CH3COO-+H2O![]() CH3COOH+OH-;
CH3COOH+OH-;
(4)水中溶解二氧化碳,二氧化碳能与氢氧化钠反应,影响测定结果,所以配制溶液所用的蒸馏水必须煮沸以除去溶解在水中的二氧化碳;
(5)设10mL市售白醋样品含有 CH3COOOH xg,则
CH3COOOH~NaOH
60 40
xg×0.2 cmolL-1×V×10-3L×40g/mol
解得:x=0.3cV
则原食醋样品的总酸量=0.3cV×10=3cVg/100mL。