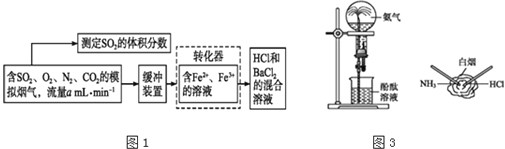
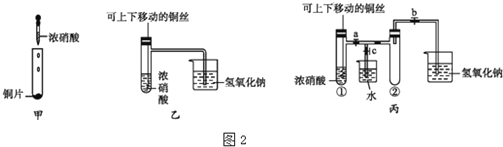
题目内容
【题目】硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)=Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH=____________。
Ⅱ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法:反应原理:恒温恒容时2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度如图:
S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度如图:
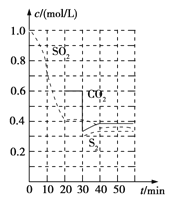
①0~20 min反应速率表示为v(SO2)=____________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是____________;
③平衡常数的表达式K=____________。
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是____________(填序号)。
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
d.水电离出c(H+)=1×10-8mol/L
(3)电化学处理法

①如图所示,Pt(Ⅰ)电极的反应式为__________________;
②当电路中转移0.02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加________mol离子。
【答案】-1473.2 kJ·mol-1 0.03 mol/(L·min) 减少CO2的浓度 K=c(S2)·c2(CO2)/c2(SO2) SO32-+SO2+H2O=2HSO3- abc SO2-2e-+2H2O=SO42-+4H+ 0.03
【解析】
Ⅰ.已知:①BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
②BaS(s)=Ba(s)+S(s) ΔH=+460 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
根据盖斯定律反应③×2-反应①-反应②可得热化学方程式为Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH=(-221×2-460-571.2) kJ·mol-1=-1473.2 kJ·mol-1。
Ⅱ.(1)①由图可知,0~20分钟内二氧化硫浓度变化量为1mol/L-0.4mol/L=0.6mol/L,故二氧化硫的反应速率=0.6mol/L÷20min=0.03 mol/(L·min)。
②30分钟时瞬间,二氧化碳的浓度降低,S2的浓度不变,而后二氧化碳和S2的浓度均增大,应是减小二氧化碳的浓度。
③其平衡常数为生成物的浓度幂之积与反应物浓度的幂之积的比值,即K=c(S2)·c2(CO2)/c2(SO2);
(2)①亚硫酸钠溶液与二氧化硫反应生成亚硫酸氢钠,反应离子方程式为SO32-+SO2+H2O=2HSO3-。
②a.根据电荷守恒,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),所以c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-),正确。b.溶液中的硫元素以亚硫酸根,亚硫酸氢根和亚硫酸的形式存在,与钠元素的关系为1:1,所以有c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),正确。c.在亚硫酸氢钠溶液中亚硫酸氢根的电离大于水解,所以离子浓度关系为c(Na+)>c(HSO3-)>c(H+)>c(SO32-),正确。d.水电离出的氢离子浓度等于水电离出的氢氧根离子浓度,由于亚硫酸氢钠溶液的pH未知,所以不能计算水电离出c(H+)浓度,错误。所以选abc。
(3)①由图可知,Pt(Ⅰ)电极上二氧化硫被氧化成硫酸,电极反应为SO2-2e-+2H2O=SO42-+4H+。
②左侧电解反应SO2-2e-+2H2O=SO42-+4H+,根据电子守恒,生成硫酸根的物质的量为0.01mol,生成氢离子物质的量为0.04mol,为保持溶液电中性,0.01mol的硫酸根需要0.02mol的氢离子,多余的氢离子通过阳离子交换膜移动到右侧,即有0.02mol氢离子移动到右侧,故左侧溶液中增加的离子为0.03mol。

 阅读快车系列答案
阅读快车系列答案【题目】I.利用如图所示装置测定中和热的实验步骤如下:
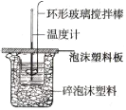
①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,使之混合均匀,测得混合溶液最高温度。
回答下列问题:
(1)所用NaOH溶液要稍过量,理由是__。
(2)环形玻璃搅拌棒搅拌溶液的操作是__。
(3)___(填“能”或“不能”)用Ba(OH)2溶液和H2SO4溶液代替NaOH溶液和盐酸,理由__。
(4)现将一定量的稀NaOH溶液、Ca(OH)2溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔΗ1、ΔΗ2、ΔΗ3,则ΔΗ1、ΔΗ2、ΔΗ3的大小关系为___。
II.实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL0.1000mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2–3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作4次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,消耗NaOH溶液的体(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 20.02 | 20.00 |
2 | 0.10 | 20.00 | 20.00 |
3 | 0.10 | 19.00 | 20.00 |
4 | 0.10 | 19.98 | 20.00 |
(1)步骤一需要称量氢氧化钠固体的质量为___g,配制标准溶液需要用到玻璃棒,烧杯外,还需要的玻璃仪器有___。
(2)根据上述数据,可计算出该盐酸的浓度为___(保留小数点后2位)。
(3)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有__。
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
III.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1)配平离子方程式:__MnO4-+__HSO3-+__H+=__
(2)用KMnO4进行滴定时,KMnO4溶液应装在___滴定管中(填酸式或碱式),判断滴定终点的现象是:滴入最后一滴KMnO4溶液时,___。