题目内容
相同状况下:H2(g)+ O2(g)===H2O(g) ΔH=-Q1kJ/mol;
O2(g)===H2O(g) ΔH=-Q1kJ/mol;
2H2(g) +O2(g)===2H2O(l) ΔH=-Q2kJ/mol
则Q1和Q2的关系为:
 O2(g)===H2O(g) ΔH=-Q1kJ/mol;
O2(g)===H2O(g) ΔH=-Q1kJ/mol;2H2(g) +O2(g)===2H2O(l) ΔH=-Q2kJ/mol
则Q1和Q2的关系为:
| A.Q1>Q2 | B.Q1=Q2 | C.2Q1<Q2 | D.Q1= Q2 Q2 |
C
试题分析:氢气与氧气反应生成水属于放热反应,即 ΔH为负值,所以Q为正值,反应ΔH的值与书写的热化学方程式有关,化学计量数越大,ΔH越负,Q越大,A、B错误,又因为H2O(g)变为2H2O(l)为放热反应,所以2Q1<Q2,即答案为C。
点评:本题考查了热化学方程式,是高考考查的重点,本题要注意放热反应的 ΔH为负值,且要看清楚水的状态,否则很容易错选D。

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目

 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。 (NH4)2CO3(aq) △H1
(NH4)2CO3(aq) △H1
 O2(g)===CO(g) △H2
O2(g)===CO(g) △H2
 )作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知
)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知 完全发生上述反应放出
完全发生上述反应放出 的热量,热化学方程式是:
的热量,热化学方程式是: CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ·mol-1 HCO3-+H+的电离平衡常数Ka1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的电离平衡常数Ka1= 。(已知:10-5.60=2.5×10-6) 2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
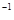 可知,金刚石比石墨稳定
可知,金刚石比石墨稳定 (aq))+OH
(aq))+OH (aq))=H
(aq))=H O(l)△H=-57.3 kJ·mol
O(l)△H=-57.3 kJ·mol 的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ