题目内容
(10分)X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种元素为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是________。
(2)ZW2的电子式是________。
(3)工业生产单质Y的原理是________________________________________(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是______________________。
(5)0.1 mol的单质W与50 mL 1.5 mol·L-1的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是________。
(1)Cl<S<Al
(2)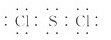 (3)2Al2O3
(3)2Al2O3 4Al+3O2↑
4Al+3O2↑
(4)Be+2NaOH+2H2O===Na2[Be(OH)4]+H2↑ (5)3∶5
【解析】根据元素的结构及有关性质可知,X、Y、Z、W分别是Be、Al、S、Cl。
(1)同周期自左向右原子半径逐渐减小,所以Y、Z、W的原子半径由小到大的顺序是Cl<S<Al。
(2)SCl2是共价化合物,其电子式是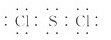 。
。
(3)铝是活泼的金属,冶炼需要通过电解法,反映的方程式是2Al2O3 4Al+3O2↑。
4Al+3O2↑。
(4)铝能与氢氧化钠反应生成偏铝酸钠和氢气,所以Be和氢氧化钠反应的方程式是Be+2NaOH+2H2O===Na2[Be(OH)4]+H2↑。
(5)亚铁离子的还原性强于溴离子的,所以氯气首先氧化的是亚铁离子。溴化亚铁的物质的量是0.075mol,则根据电子的得失守恒可知,被氧化的溴离子是0.1mol×2-0.075mol×1=0.125mol,所以被氧化的Fe2+和Br-的物质的量之比是0.075︰0.125=3︰5。

(10分)X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
|
| X | Y | Z | M | R | Q |
| 原子半径/nm |
|
| 0.186 | 0.074 | 0.099 | 0.143 |
| 主要化合价 |
| -4,+4 |
| -2 | -1,+7 | +3 |
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
|
|
|
(1)R在元素周期表中的位置是________________ ;R在自然界中有质量数为35和37的两种核素,它们之间的关系互为________________ 。
(2)Z的单质与水反应的离子方程式是__________________________________ 。
(3)根据表中数据推测,Y的原子半径的最小范围是________________ 。
(4)Z、M、Q的简单离子的离子半径的大小顺序为________________ 。
(5)Y与R相比,非金属性较强的是________________(用元素符号表示),下列事实能证明这一结论的是________________(选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR >YX4
c.Y与R形成的化合物中Y呈正价
(6)甲、乙是上述部分元素的最高价氧化物的水化物,且甲 + 乙→丙+ 水 。若丙的水溶液呈碱性,则丙的化学式是________________________________________。
(7)Y的单质能和Z的最高价氧化物的水化物的水溶液发生反应,生成相同条件下密度最小的气体。请写出该反应的化学方程式_____________________________________。
(10分)X、Y、Z、W是元素周期表前四周 期中的四种常见元素,其相关信息如下表:
期中的四种常见元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63, 中子数为 中子数为 34 34 |
(2)Y的简单离子半径 Z的简单离子半径(选填“>”、“=”、“<”)。
(3)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(4)向WYO4的水溶液中逐滴加入氨水至过量,观察到现象为
 。反应过程中涉及的离子方程式为: 、
。反应过程中涉及的离子方程式为: 、。
 ;Z的氢化物在水中可完全电离出氢离子;W原子的电子层数是其价电子数的3倍;V的单质是一种应用最为广泛的金属。
;Z的氢化物在水中可完全电离出氢离子;W原子的电子层数是其价电子数的3倍;V的单质是一种应用最为广泛的金属。 的氢氧化钠溶液中,所得溶液
的氢氧化钠溶液中,所得溶液 ;Z的氢化物在水中可完全电离出氢离子;W原子的电子层数是其价电子数的3倍;V的单质是一种应用最为广泛的金属。
;Z的氢化物在水中可完全电离出氢离子;W原子的电子层数是其价电子数的3倍;V的单质是一种应用最为广泛的金属。 的氢氧化钠溶液中,所得溶液
的氢氧化钠溶液中,所得溶液