题目内容
4.实验测得在25℃时,16g甲烷完全燃烧生成液态水和二氧化碳,放出890kJ的热量.(1)甲烷的空间构型为:正四面体;
(2)写出甲烷完全燃烧生成二氧化碳和液态水时的热化学反应方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ/mol
(3)已知1mol液态水变成气态水时需要吸收44kJ的热量,则1mol甲烷完全燃烧生成气态水和二氧化碳时放出的热量为802kJ.
分析 (1)甲烷是空间正四面体结构;
(2)依据n=$\frac{m}{M}$将甲烷的质量换算成物质的量,结合提供的热量计算1mol甲烷完全反应放出的热量,书写热化学方程式即可;
(3)已知1mol液态水汽化时需要吸收44kJ热量,依据热化学方程式和盖斯定律计算得到1mol甲烷完全燃烧产生气态水时放出的热量.
解答 解:(1)甲烷是正四面体结构的分子,故答案为:正四面体;
(2)16g即1mol甲烷完全燃烧生成液态水和二氧化碳,放出890kJ的热量,即CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ/mol;
(3)已知1mol液态水汽化时需要吸收44kJ热量,①H2O(l)=H2O(g)△H=44KJ/mol;②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ/mol;依据盖斯定律①×2+②得到CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802 kJ/mol,故答案为:802.
点评 本题主要考查了反应热的计算,题目难度不大,注意物质的量与热量成正比是解题的关键.注意焓变计算和物质聚集状态的关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列情况可能引起水污染的是( )
①农业生产中农药化肥使用不当
②工业生产中废气、废液、废渣排放不当
③石油运输过程中因泄漏流入江河
④生活污水的任意排放
⑤原子核反应的残留物随意排放.
①农业生产中农药化肥使用不当
②工业生产中废气、废液、废渣排放不当
③石油运输过程中因泄漏流入江河
④生活污水的任意排放
⑤原子核反应的残留物随意排放.
| A. | ①③⑤ | B. | ①③④⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
15.下列关于能量转换的认识中不正确的是( )
| A. | 电解水生成氢气和氧气时,电能转变成化学能 | |
| B. | 白炽灯工作时电能全部转化成光能 | |
| C. | 绿色植物光合作用过程中太阳能转变成化学能 | |
| D. | 煤燃烧时化学能主要转变成热能 |
19.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | |
| B. | 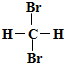 和 和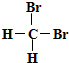 互为同分异构体 互为同分异构体 | |
| C. | CH3CH2CH2CH3与(CH3)2CHCH3互为同系物 | |
| D. | 金刚石、石墨、C60互为同素异形体 |
9.下列反应属于放热反应的是( )
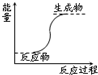

| A. | 氢氧化钡晶体和氯化铵晶体的反应 | B. | 能量变化如右图所示的反应 | ||
| C. | 不需要加热就能够发生的反应 | D. | 铁与盐酸的反应 |
13.下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )
| A. | 10℃20mL 0.3mol•L-1的盐酸溶液 | B. | 20℃30mL 0.2mol•L-1的盐酸溶液 | ||
| C. | 20℃20mL 0.2 mol•L-1的盐酸溶液 | D. | 20℃30mL 0.4 mol•L-1的盐酸溶液 |
14.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 酸性:H2SO4>H3PO4 | B. | 碱性:NaOH>Mg(OH)2 | ||
| C. | 热稳定性:Na2CO3>NaHCO3 | D. | 非金属性:Cl>Br |
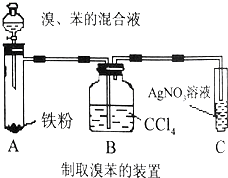 苯是一种重要的有机化工原料,广泛用于合成工业产品.回答下列问题:
苯是一种重要的有机化工原料,广泛用于合成工业产品.回答下列问题: