题目内容
【题目】【化学-选修3:物质结构与性质】
南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
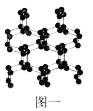
(1)N、O、F三种元素的第一电离能由大到小的顺序为____(填元素符号);与N2互为等电子体的全氧离子化学式为_______;具有空间网状结构的高聚氮结构如图一所示,则N70的沸点_____(填“>”、“<”或“=”)高聚氮的沸点,原因是_________________;N70和高聚氮属于_____(选填序号)。
A.同素异形体 B.同分异构体 C.同位素 D.同系物
(2)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3) 等。叠氮化物能形成多种配合物,在[Co(N3)(NH3)5]SO4,其中钴显____价,它的配体是____,SO42-的立体构型为___________。
(3)HN3是一种全氮阴离子酸,可由肼(N2H4)被HNO2氧化制得。下列说法正确的是____。
A.酸性:HNO2>HNO2
B. N2H4分子中N原子均采取sp3杂化
C. NaN3的晶格能小于KN3的晶格能
D.上述生成氢叠氮酸的化学方程式为N2H4+HNO2=2H2O+HN3
(4)N8是一种由全氮阳离子和全氮阴离子构成的特殊物质,已知阳离子由5个氮原子排列成V 形,每个氮原子均达到八电子稳定结构,则阳离子的电子式为_______。
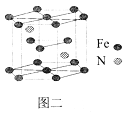
(5)一种氮铁化合物的结构如图二所示,若图中六棱柱的体积为Vcm3, 用NA表示阿伏加德罗常数的值,则该晶体的密度为______。
【答案】 F>N>O O22+ < N70是分子晶体,高聚氮是原子晶体 A +3 N3-、NH3 正四面体; BD 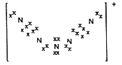
![]()
【解析】(1)N、O、F三种元素均为第二周期元素,通常第一电离能随核电荷数增大呈递增的趋势,但N的3p轨道为半充满结构相对稳定,则三种元素第一电离能由大到小的顺序为F>N>O;等电子体应具有相同的原子数目且价电子数相等,则与N2互为等电子体的全氧离子化学式为O22+ ;N70是分子晶体,而高聚氮为原子晶体,则高聚氮的沸点>N70的沸点;N70和高聚氮均为氮元素的不同单质,两者属于同素异形体;
(2)配合物Co[(N3)(NH3)5]SO4中存在SO42-、N3-、NH3,根据正负化合价代数和为0,可知Co为+3价,其中Co的配体为N3-、NH3,硫酸根中心原子的价层电子对为:孤对电子数![]() =0,成键电子对数4,所以为正四面体结构,中心原子为sp3杂化;
=0,成键电子对数4,所以为正四面体结构,中心原子为sp3杂化;
(3)A.HNO2为弱酸,而HNO3是强酸,故A错误;B.N2H4中氮原子最外层有5个电子,形成三对共用电子对,另外还有一对孤电子对,氮原子采用的都是sp3杂化,故B正确;C.NaN3与KN3结构类似,Na+半径小于K+,所以NaN3的晶格能比KN3大,故C错误;D.肼(N2H4)被HNO2氧化得氢叠氮酸,此反应的化学方程式为N2H4+HNO2=2H2O+HN3,故D正确;答案为BD;
(4)全氮阳离子由5个氮原子排列成V 形,每个氮原子均达到八电子稳定结构,可知阳离子的电子式为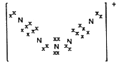 ;
;
(5)该晶体中Fe的原子个数为12×![]() +2×
+2×![]() +3=6,N原子数为2,则1mol晶胞的质量为(56×6+14×2)g=364g,则该晶体的密度为
+3=6,N原子数为2,则1mol晶胞的质量为(56×6+14×2)g=364g,则该晶体的密度为![]() =
=![]() 。
。

 阅读快车系列答案
阅读快车系列答案