题目内容
无水CuSO4在一定条件下发生如下反应:
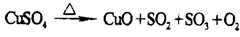
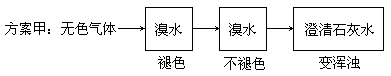
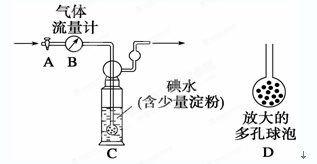
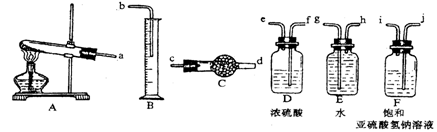
有人设计通过实验测定反应生成的SO3、SO2和O2,并经过计算确定该条件下分解反应方程式各物质的化学计量数,实验所需仪器装置如图所示。
实验测得数据及有关结果如下:
①准确称量无水CuSO4 6.0g。
②测出量筒中水的体积后,折算成排水的气体在标准状况下的体积为280ml。
③干燥管中的质量在实验结束时增加了3.2g。
④实验结束时,装置F中的溶液变成Na2SO4溶液(不含其他杂质)。
请回答如下问题:
已知气体从左向右的流向,上述仪器装置接口的连接顺序是a →ji→f e →c d →h g→ b
(1)装置F的作用是_________ ____,装置D的作用是_______ ________。
(2)首先应计算的物质是______________。
通过计算推断,该条件下反应的化学方程式是_______________ ______。
(3);(填序号)____________。
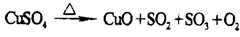
有人设计通过实验测定反应生成的SO3、SO2和O2,并经过计算确定该条件下分解反应方程式各物质的化学计量数,实验所需仪器装置如图所示。

实验测得数据及有关结果如下:
①准确称量无水CuSO4 6.0g。
②测出量筒中水的体积后,折算成排水的气体在标准状况下的体积为280ml。
③干燥管中的质量在实验结束时增加了3.2g。
④实验结束时,装置F中的溶液变成Na2SO4溶液(不含其他杂质)。
请回答如下问题:
已知气体从左向右的流向,上述仪器装置接口的连接顺序是a →ji→f e →c d →h g→ b
(1)装置F的作用是_________ ____,装置D的作用是_______ ________。
(2)首先应计算的物质是______________。
通过计算推断,该条件下反应的化学方程式是_______________ ______。
(3);(填序号)____________。
(10分)(1)吸收SO3,放出等物质的量的SO2(2分)干燥SO2和O2(2分)
O2(2分) 3CuSO4 3CuO+2SO2↑+SO3↑+O2↑(2分)(3)B E(2分)
3CuO+2SO2↑+SO3↑+O2↑(2分)(3)B E(2分)
O2(2分) 3CuSO4
 3CuO+2SO2↑+SO3↑+O2↑(2分)(3)B E(2分)
3CuO+2SO2↑+SO3↑+O2↑(2分)(3)B E(2分)试题分析:已知气体从左向右的流向,上述仪器装置接口的连接顺序是a →ji→f e →c d →h g→ b
装置F的作用是吸收SO3,放出等物质的量的SO2,装置D的作用是干燥SO2和O2,首先应计算的物质是O2;通过计算推断,测出量筒中水的体积后,折算成排水的气体在标准状况下的体积为280ml是氧气的体积;干燥管中的质量在实验结束时增加了3.2g是二氧化硫的质量;实验该条件下反应的化学方程式是3CuSO4
 3CuO+2SO2↑+SO3↑+O2↑;该实验设计中,可能给测定带来误差最大的装置是B 量筒测量的不精确。E排水的瓶子中一定还会剩余有残余气体。所以二者对实验带来的误差最大。
3CuO+2SO2↑+SO3↑+O2↑;该实验设计中,可能给测定带来误差最大的装置是B 量筒测量的不精确。E排水的瓶子中一定还会剩余有残余气体。所以二者对实验带来的误差最大。点评:此类题目一定要时刻把握实验的目的,每一步的设计都是为了实验目的的达成。弄清楚化学实验的原理是解题的关键。

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目