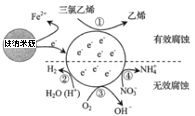
题目内容
【题目】某温度下,相同pH的两种弱酸HA和HB分别加水稀释,pH随溶液体积变化的曲线如图所示。下列判断正确的是( )
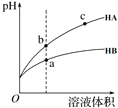
A.酸性:HB> HA
B.结合H+的能力:B->A-
C.导电能力:c > b
D.与氢氧化钠完全反应时,消耗氢氧化钠体积Va<Vb
【答案】B
【解析】
A选项,增加同样体积的水稀释时,HB的pH变化小于HA,说明加水后HB进一步电离的程度大于HA,HB的电离程度小于HA,酸性比HA弱。
B选项,酸根阴离子对应酸越弱,结合氢离子的能力越强,HA > HB,结合氢离子的能力,B-> A-,故B项正确;
C选项,c点pH大于b点,故氢离子浓度c小于b点,因此c点导电能力小于b点,故C错误;
D选项,开始pH相等,由于HA > HB,HB的电离程度小于HA,因此c(HB) > c(HA),溶液体积相等,则HB的物质的量大于HA的物质的量,因此消耗得氢氧化钠HB >HA,即Va >Vb,故D错误;
综上所述,答案为B。

 名校课堂系列答案
名校课堂系列答案【题目】铁及碳的化合物在社会生产、生活中有着广泛的应用。请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一。
已知:①Fe3O4(s)+4C(s)![]() 3Fe(s)+4CO(g) △H=+646.0kJmol﹣1
3Fe(s)+4CO(g) △H=+646.0kJmol﹣1
②C(s)+CO2(g)2CO(g) △H=+172.5kJmol﹣1
则Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)△H=___。
3Fe(s)+4CO2(g)△H=___。
(2)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
温度/K | 973 | 1173 | 1373 | 1573 |
K | 1.47 | 2.15 | 3.36 | 8.92 |
①从表中数据可推断,该反应是___(填“放热”或“吸热”)反应。
②温度为973K时,在某恒容密闭容器中发生上述反应。下列有关说法能说明该反应已达到平衡状态的是___(填字母)。
A.c(CO2)=c(CO)
B.v正(CO2)=v逆(CO)
C.体系压强不变
D.混合气体中c(CO)不变
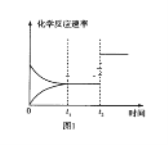
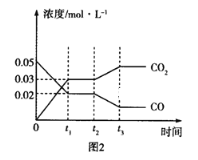
(3)如图图1、2表示反应:H2(g)+CO2(g)![]() CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:
CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:
①图2中若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=___molL﹣1s﹣1。
②图1中t2时刻改变的条件是___(任写两种,下同);图2中t2时刻改变的条件是___。
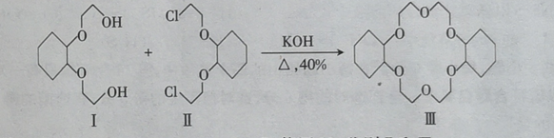
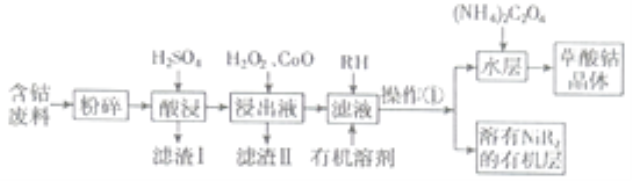
【题目】草酸钴用途广泛,可用于指示剂和催化剂的制备。用含钴废料(主要成分为![]() ,还含有一定量的
,还含有一定量的![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等)制备草酸钴晶体
等)制备草酸钴晶体![]() 的工业流程如下图所示。请回答下列问题:
的工业流程如下图所示。请回答下列问题:
已知:①草酸钴晶体难溶于水
②![]() 为有机物(难电离)
为有机物(难电离)
③相关金属离子![]() 形成氢氧化物沉淀的
形成氢氧化物沉淀的![]() 范围如下:
范围如下:
金属离子 |
|
|
|
|
开始沉淀的 | 7.5 | 2.7 | 3.4 | 6.9 |
沉淀完全的 | 9.0 | 3.7 | 4.7 | 8.9 |
(1)滤渣Ⅰ的成分_______。
(2)![]() 是一种绿色氧化剂,写出加入
是一种绿色氧化剂,写出加入![]() 后溶液中发生的主要反应的离子方程式______。
后溶液中发生的主要反应的离子方程式______。
(3)加入氧化钴调节浸出液的![]() 的范围是______。
的范围是______。
(4)加入有机溶剂的目的是______。
(5)若仅从沉淀转化角度考虑,能否利用反应![]() 将
将![]() 转化为
转化为![]() ____(填“能”或“不能”),说明理由:______。(已知
____(填“能”或“不能”),说明理由:______。(已知![]() ,
,![]() )
)
(6)为测定制得的草酸钴晶体样品的纯度,现称取样品![]() ,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液
,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液![]() 。移取
。移取![]() 该溶液加入过量的稀硫酸酸化,用
该溶液加入过量的稀硫酸酸化,用![]() 高锰酸钾溶液滴定,当溶液由__________(填颜色变化),消耗高锰酸钾溶液
高锰酸钾溶液滴定,当溶液由__________(填颜色变化),消耗高锰酸钾溶液![]() ,计算草酸钴晶体样品的纯度为__________
,计算草酸钴晶体样品的纯度为__________![]() 。(用含
。(用含![]() 、
、![]() 、
、![]() 的代数式表示)(已知
的代数式表示)(已知![]() 的摩尔质量为
的摩尔质量为![]() )
)
【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的化学试剂。欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为_____。
(2)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是_________。
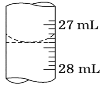
(3)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50 mL,滴定后液面如图,则此时消耗标准溶液的体积为_____。
乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.11 | 25.10 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.21 | 25.22 |
(4)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为______(保留四位有效数字)。
(5)下列哪些操作会使测定结果偏高_____ (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(6)滴定达到终点的标志是________。
【题目】现有部分短周期元素的原子结构如下表:
元素编号 | 元素原子结构 |
X | 原子结构示意图为 |
Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为 |
(1)写出X的元素符号:____________,元素Y的最简单氢化物的化学式为______________。
(2)Z元素原子的相对原子质量为____________。
(3)X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为______________。
(4)Y和Z两种元素的最高价氧化物发生氧化还原反应的化学方程式为__________________。