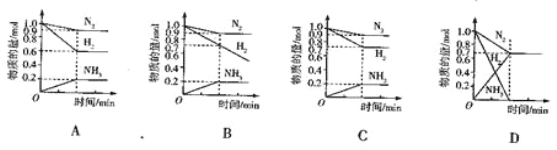
题目内容
【题目】白炭黑(SiO2·nH2O)广泛用于硅橡胶、塑料、油漆涂料等,制备白炭黑的方法主要有两种。
(l)向硅酸钠溶液中通人热的HCl气体来制取白炭黑。
① 氯化氢的电子式为________。常温下Na2SiO3溶液的pH_______(填“>”“<”或“=” ) 7。
② 用化学方程式表示该制备原理:____________。
(2)以红土镍矿(含SiO2、MgO、Fe2O3、NiO等)为原料制取白炭黑,其工艺流程如图所示。
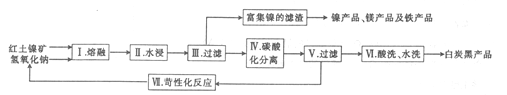
① 步骤1熔融反应器适宜的材质是_________(填“陶瓷”“玻璃”或“不锈钢”)。
② 步骤Ⅱ在稍低于100℃ 时进行水浸的目的是___________
③ 步骤Ⅳ通入过量二氧化碳并控制pH=8-9,碳酸化时发生反应的离子方程式为_____________
④ 向步骤V过滤得到的滤液中加人石灰乳,发生苛性化反应,会重新生成Na0H,该反应的化学方程式为____________。
⑤ 步骤Ⅵ酸洗后再进行水洗,某同学为加快洗涤速率,将水洗换为用无水酒精洗涤,该同学的操作___________(填“正确”或“不正确”)
【答案】 ![]() > 2HCl+Na2SiO3+(n-1)H2O=SiO2·nH2O↓+2NaCl 不锈钢 加快浸取速率 SiO32-+2CO2+(n+1)H2O=SiO2·nH2O↓+2HCO32- NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O 不正确
> 2HCl+Na2SiO3+(n-1)H2O=SiO2·nH2O↓+2NaCl 不锈钢 加快浸取速率 SiO32-+2CO2+(n+1)H2O=SiO2·nH2O↓+2HCO32- NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O 不正确
【解析】(l)① 氯化氢是共价化合物,其电子式为![]() ;硅酸是弱酸,SiO32-在溶液中要水解,则常温下Na2SiO3溶液的pH> 7,显碱性;
;硅酸是弱酸,SiO32-在溶液中要水解,则常温下Na2SiO3溶液的pH> 7,显碱性;
② 向硅酸钠溶液中通人热的HCl气体得SiO2·nH2O和NaCl,根据原子守恒配平得反应化学方程式为2HCl+Na2SiO3+(n-1)H2O=SiO2·nH2O↓+2NaCl;
(2)① 高温下NaOH可以和二氧化硅反应生成硅酸钠,则步骤1熔融反应器适宜的材质不能是陶瓷或玻璃,应选择不锈钢;
② 升高温度可以加快反应速率,步骤Ⅱ在稍低于100℃ 时进行水浸的目的是加快浸取速率;
③ 根据强酸制弱酸的原理,步骤Ⅳ通入过量二氧化碳并控制pH=8-9,可生成碳酸氢钠和SiO2·nH2O,根据电荷守恒及原子守恒,可得碳酸化时发生反应的离子方程式SiO32-+2CO2+(n+1)H2O=SiO2·nH2O↓+2HCO32-;
④向步骤V过滤得到的滤液中含有碳酸氢钠,加人石灰乳,会重新生成Na0H和碳酸钙沉淀,发生反应的化学方程式为NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O;
⑤ 酸化后生成的SiO2·nH2O表面有附着的碳酸氢钠溶液,用无水酒精洗涤无法除去碳酸氢钠,得到的产品不纯,故此操作不正确。