题目内容
100L水煤气燃烧后共放出热量1143.3kJ。
CO(g)+1/2 O2(g)=CO2(g);△H=-282.85kJ
H2(g)+1/2 O2(g)=H2O(l);△H=-285.8kJ
该水煤气是由H2、N2、CO和CO2组成的混合气体。通入60LO2中燃烧后得到65L气体,再与NaOH溶液振荡后体积变为20L(以上体积均在标准状况下测定)。这种水煤气中各种气体的体积是多少?
CO(g)+1/2 O2(g)=CO2(g);△H=-282.85kJ
H2(g)+1/2 O2(g)=H2O(l);△H=-285.8kJ
该水煤气是由H2、N2、CO和CO2组成的混合气体。通入60LO2中燃烧后得到65L气体,再与NaOH溶液振荡后体积变为20L(以上体积均在标准状况下测定)。这种水煤气中各种气体的体积是多少?
100L这种水煤气中含H250L、CO40L、CO25L、N25L。
本题应抓住3个关键:一是热效应,4种气体中能燃烧的是H2和CO,二者燃烧放出的热量是1143.3kj;二是燃烧后气体体积的变化,可知CO和H2燃烧后,气体的体积均减少;三是被NaOH溶液吸收的是CO2。而CO2的来源有二,其一是原来的,其二是由CO燃烧生成的。
---设100L水煤气中有H2xL,CO为yL。由反应热可知:
CO(g)+1/2 O2(g)=CO2(g);△H="-282.85kj/mol"
1mol 282.85kj
yL/(22.4L/mol) m
m="y/22.4" ×282.85kj
H2(g)+1/2 O(g)=H[sub]2O(l);△H=-285.8kj/mol
1mol 285.8kj
xL/(22.4L/mol) n
n="x/22.4" ×285.8kj
故得:y/22.4 ×282.85+x/22.4 ×285.8="1143.3…………①"
由体积关系有:
CO(g)+1/2 O2(g)=CO2(g) △V
1 1/2 1 0.5
y 0.5y
H2(g)+1/2 O2(g)=H2O(g) △V
1 1/2 1.5
故得1.5x+y="100+60-65……………②"
联立①②,解得x=50(L),y="40(L)"
NaOH吸收CO2的体积为40L,所以原煤气中CO2的体积为45L-40L=5L,N2的体积为100-40-5=5L。
---设100L水煤气中有H2xL,CO为yL。由反应热可知:
CO(g)+1/2 O2(g)=CO2(g);△H="-282.85kj/mol"
1mol 282.85kj
yL/(22.4L/mol) m
m="y/22.4" ×282.85kj
H2(g)+1/2 O(g)=H[sub]2O(l);△H=-285.8kj/mol
1mol 285.8kj
xL/(22.4L/mol) n
n="x/22.4" ×285.8kj
故得:y/22.4 ×282.85+x/22.4 ×285.8="1143.3…………①"
由体积关系有:
CO(g)+1/2 O2(g)=CO2(g) △V
1 1/2 1 0.5
y 0.5y
H2(g)+1/2 O2(g)=H2O(g) △V
1 1/2 1.5
故得1.5x+y="100+60-65……………②"
联立①②,解得x=50(L),y="40(L)"
NaOH吸收CO2的体积为40L,所以原煤气中CO2的体积为45L-40L=5L,N2的体积为100-40-5=5L。

练习册系列答案
相关题目
 (1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。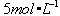 的
的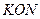 溶液100mL,恰好生成正盐。则此条件下热化学方程式:
溶液100mL,恰好生成正盐。则此条件下热化学方程式: 的
的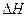 为
为


