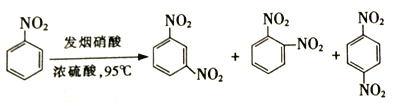
题目内容
【题目】探究碳、硅元素的非金属性的相对强弱,根据要求完成下列各小题
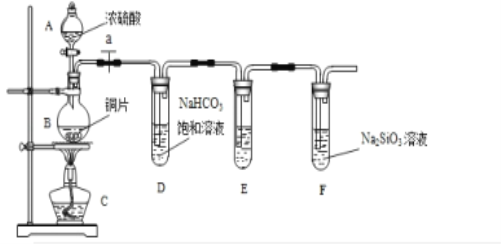
(1)实验装置: 填写所示仪器名称A__________ B___________.
(2)实验步骤:连接仪器、____________、加药品后,打开a、然后滴入浓硫酸,加热.
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是___________________.装置E中足量酸性KMnO4溶液的作用是_______________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是___________ ;
③试管D中发生反应的离子方程式是_____________________________________.
④若将铜片改为木炭,其它药品不变,也可以对该实验目的进行探究,请写出在该实验中木炭与浓硫酸反应的化学方程式_________________________________.
【答案】(1)A:分液漏斗,B:圆底烧瓶;(2)检查装置的气密性;
(3)① Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑ + 2H2O,除去SO2气体;
CuSO4 + SO2↑ + 2H2O,除去SO2气体;
② 盛有Na2SiO3溶液的试管中出现白色沉淀;
③ SO2 + 2HCO3- = SO32-+ H2O + CO2↑或SO2 + HCO3- = HSO3- + CO2↑;
④ C + 2H2SO4(浓)![]() CO2↑+ SO2↑+ 2H2O。
CO2↑+ SO2↑+ 2H2O。
【解析】
试题(1)依据实验仪器,A为分液漏斗,B为圆底烧瓶;(2)此实验有气体产生,组装好仪器后,需要检查装置的气密性;(3)①浓硫酸具有强氧化性,能和铜单质反应,其反应化学方程式:Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑ + 2H2O,SO2既具有氧化性又有还原性,酸性高锰酸钾具有强氧化性,发生氧化还原反应,故E的作用:除去SO2气体,防止对后面实验产生干扰;②亚硫酸的酸性强于碳酸,从D试管中出来的气体有CO2、SO2,酸性高锰酸钾溶液除去SO2,碳酸的酸性强于硅酸,利用酸性强的制取酸性弱的,故F中有白色沉淀,溶液变浑浊;③SO2属于酸性气体,亚硫酸的酸性强于碳酸,利用酸性强的制取酸性弱的,其离子反应方程式为: SO2 + 2HCO3- = SO32-+ H2O + CO2↑或SO2 + HCO3- = HSO3- + CO2↑;④浓硫酸具有强氧化性,表现在加热条件下与木炭发生氧化还原反应,其反应方程式为:C + 2H2SO4(浓)
CuSO4 + SO2↑ + 2H2O,SO2既具有氧化性又有还原性,酸性高锰酸钾具有强氧化性,发生氧化还原反应,故E的作用:除去SO2气体,防止对后面实验产生干扰;②亚硫酸的酸性强于碳酸,从D试管中出来的气体有CO2、SO2,酸性高锰酸钾溶液除去SO2,碳酸的酸性强于硅酸,利用酸性强的制取酸性弱的,故F中有白色沉淀,溶液变浑浊;③SO2属于酸性气体,亚硫酸的酸性强于碳酸,利用酸性强的制取酸性弱的,其离子反应方程式为: SO2 + 2HCO3- = SO32-+ H2O + CO2↑或SO2 + HCO3- = HSO3- + CO2↑;④浓硫酸具有强氧化性,表现在加热条件下与木炭发生氧化还原反应,其反应方程式为:C + 2H2SO4(浓)![]() CO2↑+ SO2↑+ 2H2O。
CO2↑+ SO2↑+ 2H2O。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压)取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是( )
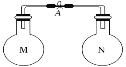
编号 | ① | ② | ③ | ④ |
气体M | HI | NH3 | H2 | NO |
气体N | Cl2 | HCl | N2 | O2 |
A. ①②③④ B. ③①④② C. ④①②③ D. ①④③②
【题目】卤素及其化合物在生活、生产等领域有广泛应用。
(1)从海带等富含碘的物质中提取碘的工艺步骤之一为:在稀硫酸酸化作用下.用二氧化锰氧化I-,其离子方程式为____,该反应的还原产物为______(填化学式).
(2)从海水中提取溴的过程是:向酸化的海水中通入氯气![]() 富集溴
富集溴![]() 氧化溴
氧化溴![]() 提纯溴。
提纯溴。
已知部分信息(其中a>0,b>0);
Ⅰ.H2(g)+Cl2(g)=2HCl(g)ΔH=-akJ/mol
Ⅱ.H2(g)+Br2(g)=2HBr(g)ΔH2=-bkJ/mol
Ⅲ.几种化学键的键能数据如表所示:
化学键 | H-Br | H-Cl | Cl-Cl | Br-Br |
键能/(KJ/mol) | 366 | 432 | 243 | 194 |
①酸化海水的目的是_______
②比较大小:a_____b(填“>”、“=”或“<”)
③计算2HBr(g)+Cl2(g)=2HCl(g)+Br2(g)ΔH=_____kJ/mol(填具体数值)=_____kJ/mol (填含a,b的代数式)
(3)298K,取一定量的含Br-、Cl-的浓缩溶液。滴加稀硝酸银溶液。当生成浅黄色沉定时存在平衡: AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq),该反应的化学平衡常数为_______已知:[Ksp(AgCl)=1.54×10-10、Ksp(AgBr)=7.7×10-13]。
AgBr(s)+Cl-(aq),该反应的化学平衡常数为_______已知:[Ksp(AgCl)=1.54×10-10、Ksp(AgBr)=7.7×10-13]。
(4)常温下Fe3+和I-在水中的反应为2Fe3+(aq)+2I-(aq)![]() 2Fe2+(aq)+I2(aq)(不考虑离子水解)。下列情况能说明该反应达到平衡状态的是_____(填字母)
2Fe2+(aq)+I2(aq)(不考虑离子水解)。下列情况能说明该反应达到平衡状态的是_____(填字母)
A.Fe3+的消耗速率率等于Fe2+的生成速率
B.溶液的颜色保持不再变化
C.2v(I-)逆=v(I2)正
D.溶液中的c(Fe3+)=c(I-)
E.溶液中的![]() 保持不再变化
保持不再变化
(5)CuBr2是一种重要的化工原料,在密闭容器中投入足量的CuBr(s),在一定温度下发生反应:2CuBr2(s)![]() 2CuBr(s)+Br2(g)反应达到平衡时,c(Br2)=10mol/L。如果温度保持不变,将容器体积用缩至原来的一。则平衡时c(Br2)的浓度(mol/L)可能为____mol/L (填字母)。
2CuBr(s)+Br2(g)反应达到平衡时,c(Br2)=10mol/L。如果温度保持不变,将容器体积用缩至原来的一。则平衡时c(Br2)的浓度(mol/L)可能为____mol/L (填字母)。
A.0.5 b.1.0 c.3.0 d.4.0