题目内容
【题目】为了确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别滴加相同浓度盐酸30.0mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如表.
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2的体积(mL) | 672 | 840 | 896 | 672 |
(1)样品中物质的量之比n(Na2CO3):n(NaHCO3)=;
(2)盐酸的物质的量浓度c(HCl)= .
【答案】
(1)2:1
(2)2.5mol/L
【解析】解:(1)结合Ⅰ、Ⅱ、Ⅲ可知,随着样品质量增加,生成二氧化碳的体积逐渐增大,说明Ⅰ、Ⅱ中盐酸过量,Na2CO3和NaHCO3的完全反应,设出Ⅰ中Na2CO3、NaHCO3的物质的量分别为x、y,则①106x+84y=2.96、②x+y= ![]() =0.03mol,联立①②解得:x=0.02mol、y=0.01mol,所以样品中物质的量之比n(Na2CO3):n(NaHCO3)=0.02mol:0.01mol=2:1;
=0.03mol,联立①②解得:x=0.02mol、y=0.01mol,所以样品中物质的量之比n(Na2CO3):n(NaHCO3)=0.02mol:0.01mol=2:1;
(2)根据实验Ⅲ、Ⅳ可知,Ⅳ中盐酸不足,Na2CO3优先反应生成NaHCO3,设6.66g样品中含有碳酸钠、碳酸氢钠的物质的量分别为2x、x,则106×2x+84x=6.66,解得:x=0.0225mol,即6.66g样品中含有0.045mol碳酸钠、0.0225mol碳酸氢钠,将样品加入盐酸中,先发生反应HCl+Na2CO3=NaHCO3+NaCl,0.045mol碳酸钠完全反应消耗HCl的物质的量为0.045mol,碳酸钠完全反应后发生再发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,生成标准状况下672L二氧化碳消耗HCl的物质的量为:n(HCl)=n(CO2)= ![]() =0.03mol,所以30mL盐酸中含有HCl的物质的量为:0.045mol+0.03mol=0.075mol,该盐酸的物质的量浓度为:c(HCl)=
=0.03mol,所以30mL盐酸中含有HCl的物质的量为:0.045mol+0.03mol=0.075mol,该盐酸的物质的量浓度为:c(HCl)= ![]() =2.5mol/L,
=2.5mol/L,
所以答案是:(1)2:1;(2)2.5mol/L.

【题目】下列物质的化学性质与实际应用对应关系正确的是( )
化学性质 | 实际应用 | |
A | NH3具有碱性 | 用作制冷剂 |
B | SO2是酸性氧化物 | 用于纸张漂白 |
C | 漂白粉具有氧化性 | 用于漂白织物 |
D | FeCl3能与碱溶液反应 | 用于蚀刻铜制线路板 |
A.AB.BC.CD.D
【题目】下列物质分类的正确组合是
类别 组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | A12O3 | H2SO4 | KOH | NaHCO3 |
B | CO | Na2O | HC1 | NaOH | NaCl |
C | SO2 | Na2O2 | CH3COOH | Na2CO3 | CaF2 |
D | SO3 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A. A B. B C. C D. D
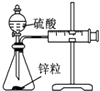
【题目】用下列实验装置进行相应的实验,不能达到实验目的是( )
A | B | C | D | |
装置 |
|
|
|
|
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性Cl>C>Si |
A.A
B.B
C.C
D.D