题目内容
某无色溶液中加入碳酸氢铵能产生气体,则在该溶液中一定能够大量共存的离子组是( )
| A.H+、Mg2+、NO3—、AlO2— |
| B.K+、Na+、Cl-、MnO4— |
| C.Na+、K+、SO42—、Cl- |
| D.NH4+、Na+、F-、ClO4— |
C
根据题给条件,该溶液为无色,从而排除选项B,因为存在MnO4—的溶液呈紫红色。又该溶液能与碳酸氢铵反应放出气体,说明该溶液可能呈酸性也可能呈碱性,这就要求组内离子在酸性、碱性溶液中都能大量存在。选项A中的H+、Mg2+在碱性溶液中不能大量存在,AlO2—在酸性溶液中不能大量存在;选项D中的NH4+在碱性溶液中不能大量存在,F-在酸性溶液中不能大量存在。

练习册系列答案
相关题目
 +、Mn2+等
+、Mn2+等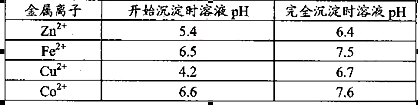
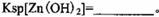 。
。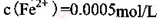 ,则处理1
,则处理1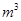 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。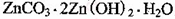 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。